
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,一定是CO32- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| C. | 向AlCl3溶液中加入氨水产生白色沉淀,继续滴加至过量沉淀溶解 | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ |
分析 A.该气体可能为二氧化碳或二氧化硫,原溶液中可能含有亚硫酸根离子、碳酸氢根等离子;
B.该沉淀可能为碳酸钙,溶液中可能含有钙离子;
C.氨水为溶解,氨水过量后氢氧化铝不会溶解;
D.该气体一定为氨气,说明溶液中一定含有铵根离子.
解答 解:A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,该气体可能为二氧化碳或二氧化硫,原溶液中可能含有碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子,不一定是CO32-,故A错误;
B.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,该沉淀可能为碳酸钙,原溶液中可能含有钙离子,不一定有Ba2+,故B错误;
C.向AlCl3溶液中加入氨水产生氢氧化铝白色沉淀,由于氨水为弱碱,继续滴加至过量沉淀不溶解,故C错误;
D.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,该气体一定为氨气,则溶液中一定有NH4+,故D正确;
故选D.
点评 本题考查了常见离子的检验方法,题目难度不大,明确常见离子的性质及检验方法为解答关键,注意检验离子的存在时,必须排除干扰,确保检验方案的严密性.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | Wg该原子的物质的量一定是$\frac{W}{aNA}$mol | |
| C. | 该原子的相对原子质量是$\frac{12}{a}$ | |
| D. | 由已知信息可得:NA=$\frac{12}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z至少有一种为稀有气体元素 | B. | X、Y、Z可以组成共价化合物 | ||
| C. | 简单阴离子还原性强弱为Y>Z>X | D. | 原子半径大小为Z>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 屠呦呦女士通过研究青蒿素获得了“诺贝尔医学奖”以表彰她对疟疾治疗所做的贡献.那么青蒿素的结构式为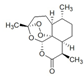 ,分子式为C15H20O5 ,分子式为C15H20O5 | |
| B. | 向鸡蛋清溶液中分别加入(NH4)2SO4和CuSO4溶液都能使鸡蛋清聚沉,其作用原理相同 | |
| C. | 淀粉,纤维素,油脂均能发生水解,同时它们都是高分子化合物 | |
| D. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com