
铁及其化合物与生产、生活关系密切.
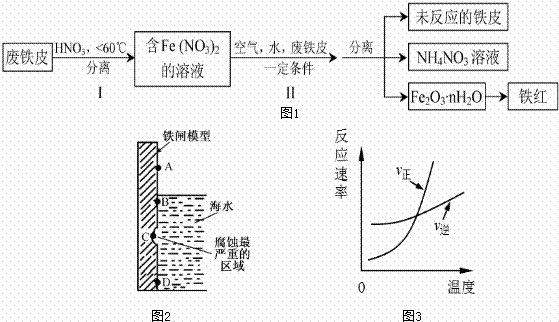
(1)如图2是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图这一腐蚀过程中发生还原反应的物质是 (填化学式).图2中A、B、C、D四个区域,生成铁锈最多的是 (填字母).
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:(图1)
步骤 I若温度过高,将不利于反应的进行,用适当的文字和化学方程式进行解释: .
步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O→2Fe2O3?nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 上述生产流程中,能体现“绿色化学”思想的是 (任写一项).
(3)已知t℃时,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数为K1.写出K1的表达式 .若该反应在恒容容器中反应时满足图3所示变化,则该反应的正反应为 反应(选填“吸热”或“放热”).若在t℃的2L恒温密闭容器中加入0.02mol FeO(s),并通入一定量CO.若5min后FeO(s)转化率为50%,则CO2的平均反应速率为 .
| 金属的回收与环境、资源保护;化学平衡建立的过程. | |
| 专题: | 化学平衡专题;元素及其化合物. |
| 分析: | (1)①由图可知,海水溶液为弱酸性,发生吸氧腐蚀,氧气具有强氧化性,充当氧化剂,被还原; ②A发生化学腐蚀,B发生电化学腐蚀,C已经腐蚀后有氧化层,D在金属内部; (2)由流程图可知,Fe与硝酸反应生成硝酸亚铁,步骤Ⅱ中转化为Fe2O3•nH2O,最后得到铁红, 硝酸分解生成二氧化氮、氧气、水;产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,则Fe与硝酸反应生成硝酸亚铁、硝酸铵和水;氮氧化物为有毒气体; (3)K= 通入x mol CO,t℃时反应达到平衡.此时FeO(s)转化率为50%,即反应的FeO为0.02mol×50%=0.01mol,则 FeO(s)+CO(g)⇌Fe(s)+CO2(g) 开始 0.02 x 0 0 转化 0.01 0.01 0.01 0.01 平衡 x﹣0.01 0.01 结合化学反应速率计算. |
| 解答: | 解:(1)由图可知,海水溶液为弱酸性,则Fe失去电子,正极上O2得到电子,发生吸氧腐蚀,A发生化学腐蚀,B发生电化学腐蚀,C已经腐蚀后有氧化层,D在金属内部,显然B中腐蚀速率最快,生成铁锈最多,故答案为:O2;B; (2)由流程图可知,Fe与硝酸反应生成硝酸亚铁,步骤Ⅱ中转化为Fe2O3•nH2O,最后得到铁红;硝酸分解生成二氧化氮、氧气、水,该反应为4HNO3 故答案为:4HNO3 (3)依据化学反应方程式得出:平衡常数K= t℃时反应达到平衡.此时FeO(s)转化率为50%,即反应的FeO为0.02mol×50%=0.01mol,则 FeO(s)+CO(g)⇌Fe(s)+CO2(g) 开始 0.02 0 转化 0.01 0.01 平衡 0.01 故v(CO2)= |
| 点评: | 本题考查较综合,涉及化学平衡计算、电化学腐蚀及物质的制备流程等,为高频考点,侧重分析能力及计算能力的考查,把握化学反应原理及图象、流程的分析为解答的关键,题目难度中等. |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示:
 (1)工业制取镁的方法是 ▲ 法。
(1)工业制取镁的方法是 ▲ 法。
(2)试剂Ⅰ一般选用 ▲ (填化学式)。
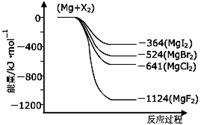
(3)右图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
①由图可知Mg与卤素单质的反应均为 ▲ (填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2 ▲ MgF2(填“>”、“=”或“<”)。
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式 ▲ 。
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是( )
|
| A. | 卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
|
| B. | 卤化氢的键长按H﹣F、H﹣C1、H﹣Br、H﹣I的顺序依次减小 |
|
| C. | 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 |
|
| D. | 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碳纳米管是近年来材料科学研究的热点.为除去碳纳米管中的杂质﹣﹣碳纳米颗粒(少量碳原子的聚集体),可以将样品溶解于强酸性的K2Cr2O7溶液中充分反应,当溶液由橙色转变为墨绿色(Cr3+)即可,同时放出一种无毒的气体.以下判断正确的是( )
|
| A. | 可以用浓盐酸调节K2Cr2O7溶液的酸性 |
|
| B. | 该过程中每氧化2 mol碳纳米颗粒,转移8NA个电子 |
|
| C. | 若将该反应设计为原电池,则碳纳米颗粒应作为原电池的正极 |
|
| D. | 可以通过过滤的方法最终得到碳纳米管 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:4NH3+5O2 4NO+6H2O,4NO+3O2+2H2O→4HNO3
4NO+6H2O,4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80.
(1)a mol NO完全转化为HNO3理论上需要氧气 mol.
(2)为使NH3恰好完全氧化为NO,氨﹣空气混合气体中氨的体积分数(用小数表示)为 (保留2位小数).
(3)20.0mol NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量硝酸,以及其他成分(高温下NO与O2不化合).计算氨转化为NO和HNO3的总转化率.
(4)20.0mol NH3和一定量空气充分反应后,再转化为硝酸.通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线.
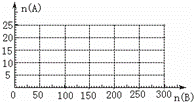
查看答案和解析>>
科目:高中化学 来源: 题型:
利用下图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | |
| A | 稀硫酸 | Na2S | AgNO3与 AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) |
|
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:4NH3(g)+5O2(g)===4NO(g)+6H2O(g);ΔH=-1 025 kJ/mol,该反应是一个
可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
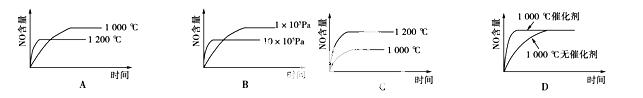
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com