
 )反应能得到化学式为C7H5O3Na的是( )
)反应能得到化学式为C7H5O3Na的是( )| A. | NaHCO3溶液 | B. | Na2CO3溶液 | C. | NaOH溶液 | D. | NaCl溶液 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯与碘水混合振荡,水层颜色变浅发生萃取 | |
| B. | 乙烯使溴水褪色 | |
| C. | 甲烷与氯气光照下反应 | |
| D. | 乙烯与氯化氢在一定条件下反应制取纯净的一氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将金属钠投入水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 大理石与醋酸的反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 三氯化铁溶液中加入铜粉:Cu+Fe3+═Cu2++Fe2+ | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池Zn为负极,ZnO为正极,MnO2为催化剂 | |
| B. | 导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn | |
| C. | 该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH- | |
| D. | 电池工作时正极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
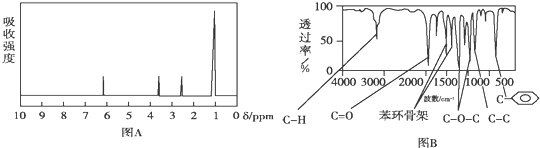
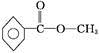 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温灼烧CuO固体 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 硫粉与铁粉混合加热 | D. | 将金属Cu投入FeCl3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
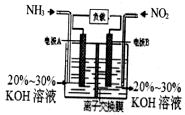 利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为:2NH3-6e-=N2+6H+ | |
| D. | 当有4.48LNO2被处理时,转移电子数为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com