
短周期A、B、C、D、E五种主族元素,原子序数依次增大,B、C、E最外层电子数之和为11,A原子最外层电子数是次外层电子数的2倍,C是同周期中原子半径最大的元素,工业上一般通过电解氧化物的方法获得D的单质,E单质是制备太阳能电池的重要材料。下列说法正确的是
A. 相同质量的C和D单质分別与足量稀盐酸反应时,后者生成的氢气多
B. C与D的最高价氧化物对应的水化物的碱性相比,后者更强
C. 不用电解氯化物的方法制备单质D是由于其氯化物的熔点高
D. 简单离子半径:B<C
科目:高中化学 来源:2016-2017学年江苏省高二学业水平测试化学试卷(解析版) 题型:选择题
下列诗句描述的过程包含化学变化的是
A. 千锤万凿出深山 B. 雪融山顶响流泉
C. 吹尽狂沙始到金 D. 蜡炬成灰泪始干
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:填空题
氨在国民经济中占有重要地位。
I.合成氨工业中,初始时氮气、氢气的体枳比为1:3时,每反应1mol N2,放出92.2kJ热量。
(1)工业合成氨的热化学方程式是_________________。
(2)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数。
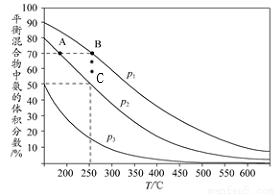
①由图可知:p1、p2、p3的大小关系为____________,理由是___________________。
②A、B点生成氨气的速率大小关系为____________________。B、C点,合成氨反应的化学平衡常数大小关系为__________,C点,N2的转化率为_____。③下列关于合成氨的说法正确是______(填序号)。
A.断开1个N=N键的同时有6个N—H键形成,反应一定达到平衡状态
B.混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利用提离H2的转化率
II.最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其电池反应为4NH3+3O2==2N2+6H2O,你认为电解质溶液应显_______(填“酸性”“中性”或“碱性”),写出负极的电极反应式:_________。若电池产生的电流为1A,反应时间为1小时,氨气的转化率为80%,则最低需要______mol氨气(列出计算式即可,已知一个电子的电量是1.6×10-19C)。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三下学期周练(四)理科综合化学试卷(解析版) 题型:选择题
下列关于实验Ⅰ~Ⅳ的说法正确的是
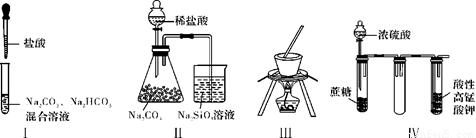
A. 实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡
B. 实验Ⅱ:通过实验现象可比较氯、碳、硅三种元素的非金属性强弱
C. 实验Ⅲ:本装置可以用于从饱和食盐水制取NaCl晶体
D. 实验Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:推断题
U、V、W、X、Y、Z是原子序数依次增大的短周期元素。已知:
①WU4++XU-==WU3+U2X,各种反应物和生成物的电子总数都与Y+相等;
②Z的单质在X2中燃烧的产物可使品红溶液褪色;
③V的单质在X2中燃烧可生成VX和VX2两种气体;
④Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)写出Y2X2与水反应的化学方程式:________________。
(2)V、W、X形成的10电子氢化物中,沸点最高的是__________(写化学式)。
(3)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为__________。
(4)常温下,向pH=11的Y2VX3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是_________。
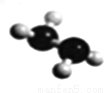
(5)已知由U、W两种元素组成的共价化合物联氨的球棍模型如图所示,则联氨分子的电子式为____________。联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_______(已知:N2H4+H+==N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与过量硫酸形成的酸式盐的化学式为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:计算题
某有机物A与氢气的相对密度是30,取有机物A 6.0g完全燃烧后,生成0.2molCO2和0.2molH2O。此有机物既可与金属钠反应,又可与氢氧化钠和碳酸钠反应。
(1)计算该有机物的分子式。
(2)根据该有机物的性质,写出其结构简式。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
实验室里需要配制480mL 0.10mol·L-1的硫酸铜溶液,下列实验方案及实验操作正确的是
选项 | 容量瓶容积 | 溶质质量 | 实验操作 |
A | 480mL | 硫酸铜:7.68g | 加入 500mL水 |
B | 480mL | 胆矾:12.0g | 配成500mL溶液 |
C | 500mL | 硫酸铜:8.0g | 加入500mL水 |
D | 500mL | 胆矾:12.5g | 配成500mL溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三(实验班)第十次月考理综化学试卷(解析版) 题型:填空题
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇。
(1)已知①C(s)+O2(g)=CO2(g) ΔH1
②2H2(g)+O2(g)=2H2O (l) ΔH2
③H2O (l)= H2O (g) ΔH3
则碳与水蒸气反应C(s)+2H2O(g) CO2(g)+2H2(g)的ΔH =________。
CO2(g)+2H2(g)的ΔH =________。
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH<0
CH3OH(g)+H2O(g)ΔH<0
①工业生产过程中CO2和H2的转化率________(填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是_______________(填两点)。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如下图所示。该温度下的平衡常数为______(保留三位有效数字)。

改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器).反应过程中部分数据见下表:
CH3OH(g)+H2O(g)中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器).反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)___K(Ⅱ)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(Ⅰ)___c(Ⅱ)。
②对反应Ⅰ,前10 min内的平均反应速率υ(CH3OH)=______,若30 min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_____移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三下学期第一次月考化学试卷(解析版) 题型:选择题
化学与社会、生活、医学、环境密切相关,下列叙述错误的是
①在工业生产中,研制出在较低温度和压强下能使反应迅速进行的催化剂,可起到很好的节能效果,能体现十八大提出的“绿色发展”理念
②药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性
③不需要通过化学反应就能从海水中获得食盐和淡水
④将水中的铁闸门连接电源的负极而防腐,利用牺牲阳极的阴极保护法
⑤屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理
⑥工业上获得大量乙烯、丙烯、丁二烯的方法是石油的裂化
⑦K2FeO4是新型水处理剂,其原理与明矾相同
⑧“雾霾积聚难见路人”雾霾所形成的气溶胶有丁达尔效应
A. ②④⑥⑧ B. ①②⑦⑧ C. ②④⑥⑦ D. ③⑤⑥⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com