
��һ����ɱ���ܱ������У�����һ������X��Y��������ӦmX��g�� nY��g������ H=Q kJ/mol����Ӧ�ﵽƽ��ʱ��Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ��
nY��g������ H=Q kJ/mol����Ӧ�ﵽƽ��ʱ��Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ��
�������L /c��Y��:mol•L��1 �¶ȡ� | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
����˵����ȷ���ǣ� ��
A��m��n
B��Q��0
C���¶Ȳ��䣬ѹǿ����Y��������������
D��������䣬�¶����ߣ�ƽ�����淴Ӧ�����ƶ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����Ѻ������ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
���л�ѡ�����л���DBP��������ά����֬�;�����ϩ�����ܼ����ر��������� ����ά��Ϳ�ϡ������������ܽ��ԡ���ɢ�Ժ�ճ���ԡ����л���A���ڶ�
����ά��Ϳ�ϡ������������ܽ��ԡ���ɢ�Ժ�ճ���ԡ����л���A���ڶ� �ױ�Ϊԭ�Ͽ��Ժϳ�DBP��
�ױ�Ϊԭ�Ͽ��Ժϳ�DBP��
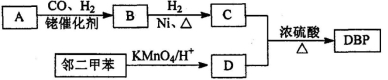

����A���л��ϳɵ���Ҫԭ�ϡ�A������ͼ���m/zΪ42��������ױ��������к���̼̼˫����B�ܷ���������Ӧ���л���C�ĺ˴Ź���������ʾ������к���5�ֻ�ѧ������ͬ����ԭ�ӣ��� ����֮��Ϊ3��2��2��2��l��
����֮��Ϊ3��2��2��2��l��
�ش��������⣺
��1��A�Ľṹ��ʽΪ________��A ��һ�����������ɾۺ���Ļ�ѧ����ʽΪ_______________��
��һ�����������ɾۺ���Ļ�ѧ����ʽΪ_______________��
��2��D�еĺ�����������___________���л���D�������л���C��Ӧ����DBP�Ļ�ѧ����ʽ��____________________________________________��
��3������˵����ȷ����___________ ��ѡ�������ĸ����
A��A�ܷ����ۺϷ�Ӧ���ӳɷ�Ӧ��������Ӧ
B����C ��Ϊͬ���칹�壬�Һ�����ͬ�����ŵ���
��Ϊͬ���칹�壬�Һ�����ͬ�����ŵ��� ������2��
������2��
C���ڶ��ױ�����������D˵���л�������л���֮�����Ӱ��
D��1 mol DBP���뺬4mol NaOH����Һ��ȫ��Ӧ
��4����ҵ�ϳ����л���E��C8H4O3������D����DBP����Ӧ��Ϊ�������У�
i��E+C ���� ii������+C
���� ii������+C 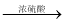 DBP+H2O
DBP+H2O
����²�E�Ľṹ��ʽ___________��[
�ڹ�ҵ�������л���E�ķ�Ӧ���£�2X+9O2 2E+4CO2+4H2O��������X��һ�����ֻ�����֡�X�Ľṹ��ʽ��________��
2E+4CO2+4H2O��������X��һ�����ֻ�����֡�X�Ľṹ��ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�찲��ʦ���и������һ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
�����⻯��NH3��N2H4���ڹ�ũҵ���������պ���������й㷺Ӧ�á�
��1��Һ����Ϊһ��DZ�ڵ��������ȼ����Խ��Խ���о���Ա���ӡ����ڰ�ȫ�ԡ��۸�ȷ���ϻ�ʯȼ�Ϻ���ȼ�����Žϴ�����ơ�����ȼ��ʵ���漰����������صķ�Ӧ��
��4NH3(g)��5O2(g)��4NO(g)��6H2O(l) ��H1
��4NH3(g)��6NO(g)��5N2(g)��6H2O(l) ��H2
��Ӧ 4NH3(g)��3O2(g)��2N2(g)��6H2O(l) ��H�� �������ú��С�H1����H2��ʽ�ӱ�ʾ��
��2���ϳɰ�ʵ���У������Ϊ3 L�ĺ����ܱ������У�Ͷ��4 mol N2��9 mol H2��һ�������ºϳɰ���ƽ��ʱ���ı��¶Ȳ�õ��������±���ʾ��
�¶�(K) | ƽ��ʱNH3�����ʵ���(mol) |
T1 | 2.4 |
T2 | 2.0 |
��֪���ƻ�1 mol N2(g)��3 mol H2(g)�еĻ�ѧ�����ĵ�������С���ƻ�2 mol NH3(g)�еĻ�ѧ�����ĵ�������
����T1 T2�����������<����=������
����T2 K�£�����10min�ﵽ��ѧƽ��״̬����0~10min��H2��ƽ������v(H2)= ��ƽ��ʱN2��ת���ʦ���N2��= ��
������ͼ��ֱ�����ʱ䣨��H�����������ƽ����Է��������� ����N2��������գ�N2���������ܶȣ��ѣ��뷴Ӧʱ��Ĺ�ϵ��������ȷ���ܱ����ÿ��淴Ӧ�ﵽƽ��״̬���� ��
����N2��������գ�N2���������ܶȣ��ѣ��뷴Ӧʱ��Ĺ�ϵ��������ȷ���ܱ����ÿ��淴Ӧ�ﵽƽ��״̬���� ��

��3��ijN2H4���»�������ȼ�ϵ�أ������ȶ�������Ⱦ�����ʣ�ԭ����ͼ1��ʾ��

��M�������ĵ缫��ӦʽΪ ��
���������������Դ����ͼ2װ�õ�ⱥ���Ȼ�����Һ���缫��Ϊ���Ե缫�����豥���Ȼ�����Һ���Ϊ500mL������Һ��pHֵ��Ϊ13ʱ���ڳ����²ⶨ�� ������ȼ�ϵ�ص�����������Ϊ80%����������N2H4������Ϊ g��������Һ���ǰ��������䣩��
������ȼ�ϵ�ص�����������Ϊ80%����������N2H4������Ϊ g��������Һ���ǰ��������䣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�찲��ʡ���������������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��Z��W��R��5�ֶ�����Ԫ�أ���ԭ��������������X�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�Yԭ�������������Ǵ�����������3����Z��W��R����ͬһ���ڣ�R��Y����ͬһ�壬Z��Wԭ�ӵĺ��������֮����Y��Rԭ�ӵĺ��������֮����ȡ�����˵����ȷ���ǣ� ��
A������A��Z��Y����Ԫ����ɣ���0.5mol����A�к��е�������ԼΪ9.03��1023
B��Ԫ��Y��Z��W�γɵ����Ӿ�����ͬ���Ӳ�ṹ�������Ӱ뾶��������
C��Ԫ��Z��R���������ˮ����֮�����Ӧ���ɵ�����Һ�����Ի����
D��Ԫ��Y��R�ֱ���Ԫ��X�γɵĻ�����ķе㣺XmY��XmR
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ������
��1��п�̸ɵ����һ��һ�ε�أ����Ϊ����п���м���̼��������Χ��̼�ۣ��������̣��Ȼ�п���Ȼ�淋���ɵ������õ���ڷŵ���̲���MnOOH��������ˮ�������մ����÷ϵ�ؿ��Եõ����ֻ���ԭ�ϣ��й�������ͼ��ʾ��
�ܽ��/(g/100gˮ)
�¶�/�� ������ | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
������ | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp����ֵ | 10-17 | 10-17 | 10-39 |
�ش��������⣺
����ͨп�̵�طŵ�ʱ��������Ҫ��ӦΪ��Zn+2NH4Cl+2MnO2��Zn(NH3)2Cl2+2MnOOH���õ���У�����������Ҫ��________��������������Ҫ��Ӧʽ�� ��
���÷ϵ�ص�пƤ������ˮ������п����ȥ���������������䷽���ǣ�����ϡ�����˫��ˮ���ܽ⣬
�Ӽ������ҺpH��ʹ��Һ������������Ũ�ȴﵽ mol/L�����պ���ȫ����������Ũ��С��1��10-5mol/Lʱ��������Ϊ�����ӳ�����ȫ���������Ӽ����pHΪ ��п��ʼ�������ٶ�Zn2��Ũ��Ϊ0.1mol/L����
��2���ڷ�����ѧ�г���Na2C2O4���壨��Һ��ɫ����Ϊ�����ʲⶨKMnO4��Һ��Ũ�ȡ���H2SO4��Һ�У���Ӧ���£�2MnO��5C2O��16H��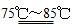 2Mn2������Һ��ɫ����10CO2����8H2O��
2Mn2������Һ��ɫ����10CO2����8H2O��
������W g Na2C2O4���100 mL����Һ����ȡ20.00 mL������ƿ�У�������KMnO4��ҺӦװ��__________(���ʽ����ʽ��)�ζ����С����εζ� ѡ��ָʾ�������Ҫ����������Ҫ�������жϵζ����յ��������____ ___��
�����ζ�����ʼ�������յ������ͼ��ʾ��������KMnO4�����ʵ���Ũ��Ϊ_ (�����ʽ)��
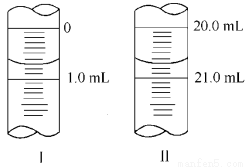
�����ζ���������������ⶨ��KMnO4��Һ��Ũ��___(�ƫ�ߡ�����ƫ�͡����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���б�����ȷ����
A��100 ��ʱ��0.1 mol��L-1 HCl��NaOH��Һ��pH�ֱ�Ϊ1��13
B����pH��4�Ĵ�����Һ��ˮϡ�ͺ���Һ���������ӵ�Ũ�Ⱦ�����
C�����������pH��HCl��CH3 COOH��Һ�ֱ���NaOH��Һ��Ӧ��CH3 COOH����NaOH�����ʵ�����
D���ڵ��з�̪��Һ�İ�ˮ�У�����NH4Cl����Һ�����ԣ�����Һ��ɫ����ʱ��Һһ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������и�һ6��ѧҵ���л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ�Dz������ռ������ʵ��װ��ʾ��ͼ����װ���ʺ���

A����H2O2��Һ��MnO2��ȡO2
B����Ũ�����MnO2��ȡCl2
C����ϡ�����Cu��ȡNO
D����NH4C1��Ca(OH)2��ȡNH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������и�һ6��ѧҵ���л�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶��£����������з������淴ӦC(s)+ 2H2O(g) CO2(g)+2H2(g)��һ����˵���÷�Ӧ�Ѵﵽƽ��״̬����
CO2(g)+2H2(g)��һ����˵���÷�Ӧ�Ѵﵽƽ��״̬����
A������1molCO2��ͬʱ����2molH2O
B��n(H2O)��n(H2)=1��1
C��2v��(H2O)=v��(CO2)
D�������������ѹǿ�������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������и߶�6��ѧҵ���л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ�� ���۲���ȷ����
���۲���ȷ����
ʵ����� | ���� | ���� | |
A | ij�л�����������Ȼ�̼��Һ��� | ��Һ��ɫ | �л��ﺬ̼̼˫�� |
B | �Ҵ����ظ���أ�K2Cr2O7����Һ��� | ��ɫ��Һ��Ϊ��ɫ | �Ҵ����л�ԭ�� |
C | �����£���������̼ͨ�뱽������Һ | ��Һ����� | ���ԣ�̼��>���� |
D | ���ͱ���ϡ��Һ�ֱ���Ũ��ˮ��� | ���߲�����ɫ���� | �ǻ�Ӱ���˱����Ļ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com