
下列物质的性质比较,正确的是( )
A.酸性:H2SO4>HClO4>HBrO4 B.碱性:NaOH>KOH>RbOH
C.非金属性: P>S>Cl D.气态氢化物稳定性:HF>H2O>PH3
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
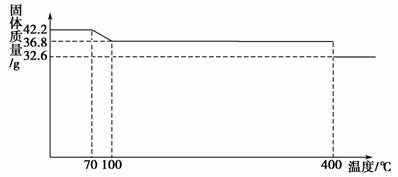
试回答下列问题:
(1)试确定150 ℃时固体物质的化学式_________________________________ _____________________________________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。
(3)在25 ℃时,将a mol·L-1的KCN溶液与0.01 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a________0.01 mol·L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____________________________________________________________。
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O===2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O,则另一个反应的离子方程式为____________________________________________________________。
上述转化的重要意义在于__________________________________ ______________________________________。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全________ _______________________________________________________________。
(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
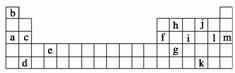
(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力
B.形成稳定结构的倾向
下表是一些气态原子核失去核外不同电子所需的能量(kJ·mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
①通过上述信息和表中的数据分析,为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量__________________________________________
________________________________________________________________________。
②表中X可能为以上13种元素中的________(填写字母)元素。用元素符号表示X和j形成的化合物的化学式____________________。
③Y是周期表中________族元素。
④以上13种元素中,________(填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2和Cl2均是常用的漂白剂,若将SO2和Cl2等物质的量混合后,先缓慢通入到BaCl2溶液中,再滴入品红试液,会观察到的现象是( )
A. 无沉淀生成,溶液显红色 B. 无沉淀生成,溶液显无色
C. 有沉淀生成,溶液显无色 D. 有沉淀生成,溶液显红色
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,用化学符号回答下列有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
| |
(1)写出下列元素的符号:①_____,⑥_____,⑦_____。
(2)在这些元素中,最活泼的金属元素是____,最活泼的非金属元素是____,最不活泼的元素是____。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是_______,碱性最强的是_____,称为两性氢氧化物的是_________。
(4)在这些元素中,原子半径最小的是____,原子半径最大的是_____。
(5)在③与④,化学性质较活泼的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是( )
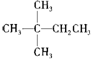 | |||
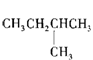 | |||
A. B.
 C.CH3CH2CH2CH2CH3 D.CH3-
C.CH3CH2CH2CH2CH3 D.CH3-
查看答案和解析>>
科目:高中化学 来源: 题型:
星形聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。
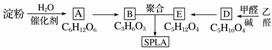

(1)淀粉是____糖(填“单”或“多”);A的名称是______。
(2)乙醛由不饱和烃制备的方法之一是_________________________________________
________________________________________________________________________
________________________________________________________________________(用化学方程式表示,可多步)。
(3)D—→E的化学反应类型属于________反应;D结构中有3个相同的基团,且1 mol D能与2 mol Ag(NH3)2OH反应,则D的结构简式是________;D与银氨溶液反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(4)B的直链同分异构体G的分子中不含甲基,G既不能与NaHCO3溶液反应,又不能与新制Cu(OH)2悬浊液反应,且1 mol G与足量Na反应生成1 mol H2,则G的结构简式为________________________________________________________________________。
(5)B有多种脱水产物,其中两种产物的结构简式为____________和________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com