
【题目】向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是
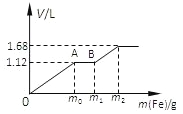
A. 开始时产生的气体为H2
B. AB段发生的反应为置换反应
C. 所用混合溶液中c(HNO3)=0.5 mol·L—1
D. 参加反应铁粉的总质量m2=5.6g
科目:高中化学 来源: 题型:
【题目】(1)把7.8g镁铝合金的粉末放入过量的盐酸中,得到8.96 LH2(标准状况下)。该合金溶于足量NaOH溶液,产生H2的体积(标准状况下)为____________ 。
(2)相同条件下,某Cl2与O2混合气体75mL恰好与100mL H2化合生成HCl和H2O,则混合气体的平均相对分子质量为____________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是2:5,则A的摩尔质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为____________;仪器b中可选择的试剂为(任意填一种)_____________。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为_______________。
(3)E装置中浓硫酸的作用是____________________________________。
(4)F中读取气体体积前,应对装置F进行的操作是:___________________,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积________ (填“偏大”或“偏小”或“无影响”);图中量气管可由________ (请选择字母填空:A.酸式滴定管,B.碱式滴定管)改装而成。
(5)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据________。
A.B装置实验前后质量差mg; B.F装置实验前后液面差VL
C.D装置实验前后质量差mg; D.E装置实验前后质量差mg;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
A.①③⑤⑦⑧B.②④⑥⑧C.①⑥D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关①100mL 0.1 mol/L![]() 、②100mL 0.1 mol/L
、②100mL 0.1 mol/L![]() 两种溶液的叙述不正确的是
两种溶液的叙述不正确的是
A.溶液中水电离出的![]() 个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:![]() D.②溶液中:
D.②溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100mL0.2mol/L的FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是( )(设溶液体积不变,不考虑水解因素)。
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L
B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,0.2mol/L![]() c(Fe2+)
c(Fe2+)![]() 0.3mol/L
0.3mol/L
D.烧杯中Fe、Cu均有,c(Fe2+)=0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三效催化转化器”可将汽车尾气中的有毒气体转化为无污染的气体,下图为该反应的微观示意图(末配平),其中不同符号的球代表不同种原子。下列说法不正确的是
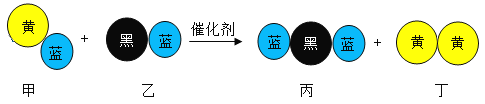
A. 该反应属于氧化还原反应
B. 配平后甲、乙、丙的化学计量数均为2
C. 甲和丙中同种元素化合价不可能相同
D. 丁物质一定是非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com