
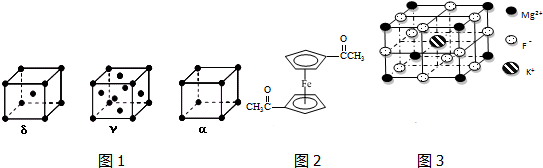
 .已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为4:3.
.已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为4:3.分析 (1)同一周期元素的第一电离能随着原子序数的增大而增大,但第五主族元素的第一电离能大于第六主族元素的;
(2)根据构造原理写出基态铁原子核外电子排布式;
(3)γ晶胞为面心立方最密堆积,利用均摊法结合晶胞的质量和体积计算密度;
(4)根据分子中碳原子的成键情况,判断碳原子的杂化方式;
(5)原子个数相同且价电子数相同的微粒是等电子体;(CN)2是直线型分子,并有对称性,结构式为:N≡C-C≡N;
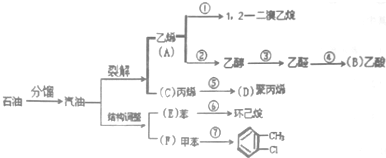
(6)根据均摊法计算晶胞中F-、Mg2+、K+离子数目确定化学式.
解答 解:(1)同一周期元素的第一电离能随着原子序数的增大而增大,但第五主族元素的第一电离能大于第六主族元素的,所以F、N、O三种元素的第一电离能由由大到小的顺序是F>N>O;
故答案为:F>N>O;
(2)铁是26号元素,其原子核外有26个电子,铁离子失去3个电子,M能层的电子排布式为3s23p63d5,
故答案为:3s23p63d5;
(3)γ晶胞为面心立方最密堆积,由晶胞结构可知晶胞δ中原子个数为1+8×$\frac{1}{8}$=2,晶胞α的原子个数为8×$\frac{1}{8}$=1,则密度ρδ:ρα=$\frac{{\frac{2M}{N_A}}}{{{{({\frac{4r}{{\sqrt{3}}}})}^3}}}:\frac{{\frac{M}{N_A}}}{{{{({2r})}^3}}}$=$\frac{3}{4}\sqrt{3}$,
故答案为:面心立方最密堆积;ρδ:ρα=$\frac{{\frac{2M}{N_A}}}{{{{({\frac{4r}{{\sqrt{3}}}})}^3}}}:\frac{{\frac{M}{N_A}}}{{{{({2r})}^3}}}$=$\frac{3}{4}\sqrt{3}$;
(4)分子中C原子以碳碳双键和碳碳单键形式存在,则碳原子的杂化方式是sp2、sp3;
故答案为:sp2、sp3;
(5)CN-中含有两个原子且价电子数是10,所以与CN-互为等电子体的一种分子的化学式:N2,电子式为 ,(CN)2是直线型分子,并有对称性,结构式为:N≡C-C≡N,(CN)2中π键和σ键的个数比为4:3;
,(CN)2是直线型分子,并有对称性,结构式为:N≡C-C≡N,(CN)2中π键和σ键的个数比为4:3;
故答案为: ;4:3;
;4:3;
(6)晶胞中F-离子数目=12×$\frac{1}{4}$=3、Mg2+离子数目=8×$\frac{1}{8}$=1、K+离子数目=1,故该晶体化学式为:KMgF3.如F-位于定点,则与之最近的F-位于同一平面的对角线,而每个定点为8个晶胞共有,所以在该晶体中与一个F-距离最近且相等的F-的个数为 8,
故答案为:KMgF3;8.
点评 本题考查了第一电离能、核外电子排布、杂化轨道、等电子体、晶胞计算等,为高频考点,侧重学生的分析能力和计算能力的考查,难度中等,利用均摊法进行晶胞有关计算.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
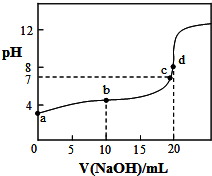 室温下,将0.1000mol/LNaOH溶液滴入20.00ml 0.1000mol/L CH3COOH溶液中,溶液pH随加入NaOH溶液体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将0.1000mol/LNaOH溶液滴入20.00ml 0.1000mol/L CH3COOH溶液中,溶液pH随加入NaOH溶液体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点:由水电离出的c(H+)=1.0×10-3mol/L | |
| B. | b点:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) | |
| C. | c点:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| D. | d点:c(OH-)-c(H+)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2×102 | B. | 3.5×102 | C. | 3.2×103 | D. | 3.6×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2 | B. | CuCO3 | C. | CuCO3•CuO | D. | Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑧ | B. | ⑦⑤⑧ | C. | ①③④ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:S>Cl>F | B. | 碱性:NaOH>Mg( 0H)2>Al( 0H)3 | ||
| C. | 稳定性:PH3<H2S<HF | D. | 离子半径:02->Na+>Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三聚氰胺 | B. | 苏丹红 | C. | 亚硝酸钠 | D. | 葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com