
| A. | 减小压强 | B. | 缩小体积 | ||
| C. | 降低温度 | D. | 增大氢气的物质的量浓度 |
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:填空题
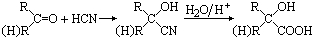 ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成: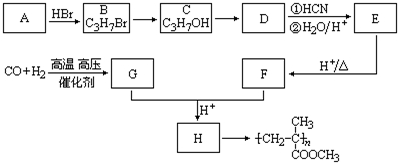
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不大于7 | B. | 一定不小于7 | C. | 一定等于7 | D. | 可能大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠可用作潜艇里氧气的来源 | |
| B. | 金属钠用于生产玻璃 | |
| C. | 乙醇可用作燃料 | |
| D. | 用漂白粉对H7N9禽流感疫区进行环境消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0×10-29mol.L-5 | B. | 3.2×10-12mol5.L-5 | ||
| C. | 6.3×10-18mol5.L-5 | D. | 5.1×10-27mol5.L-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K=$\frac{[Fe_3O_4]•[H_2]}{[Fe]•[H_2O]}$ | B. | K=$\frac{[Fe_3O_4]•[H_2]^4}{[Fe]•[H_2O]^4}$ | ||
| C. | K=$\frac{[H_2O]^4}{[H_2]^4}$ | D. | K=$\frac{[H_2]^4}{[H_2O]^4}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com