
(8分)在下图中,E和F分别为电源两极;甲烧杯中盛有100 mL 0.2mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.15 mol·L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则
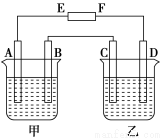
(1)E为________极,C为________极。
(2)A极的电极反应式为_________________________,析出气体________mL。(标准状况)
(3)若乙烧杯溶液体积不变,则此时溶液的物质的量浓度将变为 mol·L-1。
(4)甲烧杯中滴入石蕊试液,________极附近变红(填A或B);如果继续电解,在甲烧杯中最终得到________溶液(填溶质的化学式)。
(8分)
(1)正 阳 (各1分)
(2)4OH--4e-===2H2O+O2↑(2分) 56(1分)
(3)0.1 (1分)
(4)A HNO3(各1分)
【解析】
试题分析:(1)根据题意,B极增重1.08g,说明B极有Ag析出,所以B是阴极,A是阳极,则C是阳极,D是阴极,E是正极,F是负极;
(2)A极发生氧化反应,氢氧根离子的放电能量大于硝酸根离子,所以氢氧根离子放电,失去电子生成氧气,则电极反应式为4OH--4e-===2H2O+O2↑;因为析出Ag的质量是1.08g,物质的量是1.08g/108g/mol=0.01mol,转移电子的物质的量是0.01mol,根据得失电子守恒,生成氧气的物质的量是0.01mol/4,标准状况下的体积是0.01mol/4×22.4L/mol=0.056L=56mL;
(3)乙烧杯是电解氯化铜溶液,两极发生的反应分别是Cu2++2e-==Cu、2Cl--2e-=Cl2↑,当甲中有0.01mol电子转移时,乙析出CuCl2的物质的量是0.005mol,则溶液中剩余CuCl2的物质的量是0.1L×0.15mol/L-0.005mol=0.01mol,所以此时氯化铜溶液的浓度是0.01mol/0.1L=0.1mol/L;
(4)酸使石蕊变红色,甲中A极是氢氧根离子放电,所以氢离子浓度增大,所以A极变红色;继续电解,则甲中析出Ag和氧气,则溶液中剩余氢离子和硝酸根离子,所以最终得到HNO3溶液。
考点:考查电解反应原理的应用,氧化还原反应的计算


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列关于有机物的说法不正确的是()
A.某甲酸溶液中可能存在着甲醛,加入新制的Cu(OH)2加热,有砖红色沉淀产生,证明一定存在甲醛
B.有机物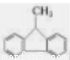 的所有碳原子可能处在同一平面上
的所有碳原子可能处在同一平面上
C.C6H14有多种同分异构体,其同分异构体中沸点最高的分子的一氯取代物有3种
D.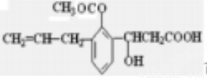 可发生取代、加成、消去、水解、氧化、加聚、缩聚反应
可发生取代、加成、消去、水解、氧化、加聚、缩聚反应
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三第三次理综考试化学试卷(解析版) 题型:选择题
已知还原性 I— > Fe2+ > Br—,在只含有I—、Fe2+、Br—溶液中通入一定量的氯气,关于所得溶液离子成分分析正确的是(不考虑Br2 、I2和水的反应)( )
A.I—、Fe3+ 、Cl— B.Fe2+、Cl—、Br‑
C.Fe2+、Fe3+ 、Cl— D.Fe2+、I— 、Cl—
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵阳市高三“一诊”模拟考试理综化学试卷(解析版) 题型:选择题
700℃时,H2(g)+CO2(g) H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol/L | 0.10 | 0.20 | 0.20 |
c(CO2)/mol/L | 0.10 | 0.10 | 0.20 |
A.平衡时,乙中CO2的转化率大于50%
B.当反应平衡时,丙中c(CO2)是甲中的2倍
C.温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵竹市高三上学期第二次月考化学试卷(解析版) 题型:实验题
(11分)海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义.
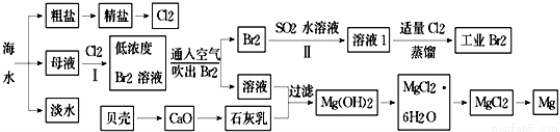
(1)氯碱工业主要以食盐为原料.为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列操作,正确的操作顺序是 .
①过滤;
②加过量的NaOH溶液;
③加适量的盐酸;
④加过量的Na2CO3溶液;
⑤加过量的BaCl2溶液.
a.②⑤④①③b.①④②⑤③c.④②⑤③①d.⑤②④①③
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是 ,所用主要仪器的名称是 .
(3)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 .
(4)步骤Ⅱ反应的离子方程式 .
(5)海水提溴蒸馏过程中,温度应控制在80~90℃,温度过高或过低都不利于生产,请解释原因 .
(6)Mg(OH)2沉淀中混有Ca(OH)2,可选用 溶液进行洗涤除去.如直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,你 (选填“同意”,“不同意”)该说法,理由是 .
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵竹市高三上学期第二次月考化学试卷(解析版) 题型:选择题
已知C(s)+H2O(g)═ CO(g)+H2(g) △H=akJ?mol﹣1
2C(s)+O2(g)═ 2CO(g) △H=﹣220kJ?mol﹣1
H﹣H、O=O和O﹣H键的键能分别为436、496和462kJ?mol﹣1,则a为
A.﹣332 B.﹣118 C.+350 D.+130
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵竹市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列物质中属于纯净物的是
①由同种元素组成的物质
②具有固定熔沸点的物质
③由相同种类和相同数目的原子组成的分子
④某种元素的阳离子和另一种元素的阴离子组成的物质
⑤在氧气中燃烧只生成二氧化碳的物质
⑥只含有一种分子的物质.
A.②③⑥ B.④⑤⑥ C.①④ D.②⑥
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:填空题
(10分)一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍: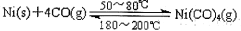 ,则该反应的△ H 0(选填“>”或“<”)。
,则该反应的△ H 0(选填“>”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式 。
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO 和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO 和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 。
(4)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
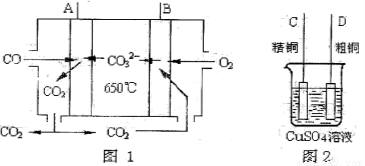
①写出A极发生的电极反应式 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
③当消耗标准状况下2.24LCO时,C电极的质量变化为 。
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高三第三次月考化学试卷(解析版) 题型:选择题
下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com