




 =
=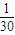 mol/L<0.1mol/L,所以溶液的PH小于14,
mol/L<0.1mol/L,所以溶液的PH小于14,

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验事实 | 结论或解释 | ① | 将40g NaOH溶于1L蒸馏水中 | 该 溶液中溶质的质量分数为3.84%,其物质的量浓度为1molL-1 | ② | 向盛有1mL 0.1mol?L-1AgNO3溶液的试管中滴加0.1molL-1NaCl溶液,至不再有沉淀生成,再向其中滴0.1molL-1 KI溶液,白色沉淀转化为黄色沉淀. |
常温下 Ksp(AgCl)<Ksp(AgI) |
③ | 某盐NaX溶液pH>7 | 酸HX为弱酸 | ④ | 向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 | 说明溶液中一定含有Fe2+ | ⑤ | 向盛有浓硝酸的试管中分别加入Al片和 Cu片,前者没有明显现象,后者反应剧烈,产生大量红棕色气体 |
还原性Al<Cu | ⑥ | BaSO4的水溶液导电性很差 | BaSO4是弱电解质 |
查看答案和解析>>
科目:高中化学 来源:朝阳区一模 题型:单选题
A.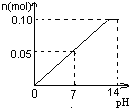 | B.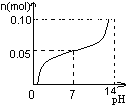 | C.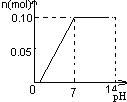 | D.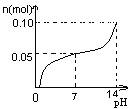 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向盛有1L 0.1mol/LNaHSO4溶液的烧杯中不断的滴加0.05mol/LBa(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液的pH的变化情况正确的是

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com