
高炉炼铁过程中发生的主要反应为
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 
 Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________,CO的平衡转化率=________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
解析:(1)因Fe和Fe2O3都为固体,不能代入平衡常数的表达式,所以K= ,由表中数据知,温度升高,平衡常数减小,说明平衡向左移动,故ΔH<0。
,由表中数据知,温度升高,平衡常数减小,说明平衡向左移动,故ΔH<0。
(2)  Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
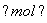 1.0 1.0
1.0 1.0
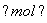 x x
x x
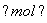 1.0-x 1.0+x
1.0-x 1.0+x
由题意得K= =4.0,解得x=0.60 mol,
=4.0,解得x=0.60 mol,
所以α(CO)= ×100%=60%,
×100%=60%,
v(CO2)= =
=
=0.006 0 mol/(L·min)。
(3)根据勒夏特列原理,A、B、E、F四项的条件改变对平衡无影响,D项升温平衡向左移动,CO转化率降低,故选C。
答案:(1) <
<
(2)0.006 0 mol/(L·min) 60% (3)C


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
已知:可逆反应2SO2(g)+O2(g)  2SO3(g) ΔH<0,在一定条件下达到平衡后,改变下列条件一定能使该平衡向正反应方向移动的是( )
2SO3(g) ΔH<0,在一定条件下达到平衡后,改变下列条件一定能使该平衡向正反应方向移动的是( )
A.升温增压 B.降温增压
C.升温减压 D.降温减压
查看答案和解析>>
科目:高中化学 来源: 题型:
2009年4月20日中央电视台报道:市场上的仿瓷餐具中有部分是加入有毒的脲醛树脂制造的。用尿素和甲醛可以合成电玉(脲醛树脂),其结构如下: ,则合成电玉的反应属于( )
,则合成电玉的反应属于( )
A.化合反应 B.加聚反应
C.缩聚反应 D.分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,不正确的是( )
A.某特定反应的平衡常数仅是温度的函数
B.催化剂不能改变平衡常数的大小
C.平衡常数发生变化,化学平衡必定发生移动达到新的平衡
D.化学平衡发生移动,平衡常数必发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
H2和CO2在高温下发生反应:
CO2(g)+H 2(g)
2(g)  CO(g)+H2O(g)。下表是986℃时,在容积不变的密闭容器中进行反应的四组数据:
CO(g)+H2O(g)。下表是986℃时,在容积不变的密闭容器中进行反应的四组数据:
| 编号 | 起始浓度/mol/L | 平衡浓度/mol/L | ||||||
| c0(H2) | c0(CO2) | c0(H2O) | c0(CO) | c(H2) | c(CO2) | c(H2O) | c(CO) | |
| 1 | 1.0 | 1.0 | 0 | 0 | 0.44 | 0.44 | 0.56 | 0.56 |
| 2 | 1.0 | 2.0 | 0 | 0 | 0.27 | 1.27 | 0.73 | 0.73 |
| 3 | 0 | 0 | 2.0 | 2.0 | 0.88 | 0.88 | 1.12 | 1.12 |
| 4 | 0.2 | 0.4 | 0.6 | 0.8 | 0.344 | 0.544 | 0.456 | 0.656 |
下列叙述中正确的是( )
①该温度下反应的平衡常数约为1.62
②该反应的平衡常数与反应的起始浓度无关
③增大CO2的起始浓度,可使CO2的转化率增大
④从反应开始至达到平衡状态,混合气体的密度没有发生改变
A.②③ B.①②③
C.①②④  D.①③
D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)  2SO3(g) ΔH=-190 kJ/mol
2SO3(g) ΔH=-190 kJ/mol
(1)该反应450℃时的平衡常数________500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)下列描述中能说明上述反应已达平衡的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=________ mol/(L·min):若继续通入0.20 mol SO2和0.10 mol O2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________ mol<n(SO3)<________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学无处不在,下列与化学有关的说法,不正确的是 ( )
A.二氧化硫具有漂白性,可广泛用于食品的增白
B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
C.碘是人体必须微量元素,所以食盐中常加入适量KIO3
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
科目:高中化学 来源: 题型:
在烧杯中盛有半杯的Ba(OH)2溶液,然后用滴管向烧杯中滴加H2SO4(装置如右图)。随着硫酸的滴入,电灯会逐渐变暗,当两者恰好完全反应时,电灯完全熄灭。

(1)该实验说明溶液的导电性与_________________有关。
(2)上述反应的离子方程式为_________________________________________。
(3)可以利用上述原理进行溶液浓度的测定。若烧杯中装有75mL 0.1mol/L Ba(OH)2溶液,当滴入25mL H2SO4时,电灯完全熄灭。试求该硫酸溶液的物质的量浓度。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com