
 某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2++CO32-=CaCO3↓(写离子方程式).Ca2++CO32-=CaCO3↓ |
| 操作2:向2mL NaHCO3溶液中滴加少量的澄清石灰水 | 白色沉淀 | 反应的离子方程式为Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
分析 (1)碳酸钠温度,受热难分解,碳酸钠热稳定性差,受热易分解,生成二氧化碳气体,二氧化碳和氢氧化钙反应生成碳酸钙沉淀;
(2)①常温下,同质量、同体积的溶剂,Na2CO3固体完全溶解,而NaHCO3固体有剩余,说明Na2CO3较NaHCO3易溶;
②碳酸钠溶解过程放热,碳酸钠为强碱弱酸盐,水解使溶液呈碱性;
(3)①同等条件下,碳酸钠与盐酸反应速率不及碳酸氢钠与盐酸反应;②等质量的Na2CO3和NaHCO3,NaHCO3物质的量较多,生成二氧化碳多;
(4)碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠;Ca(OH)2与NaHCO3溶液反应生成碳酸钙沉淀,碳酸钠和水
解答 解:(1)碳酸钠稳定,受热难分解,碳酸钠热稳定性差,受热易分解,生成二氧化碳气体,故A为碳酸氢钠,反应方程式为:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,生成的CO2气体通入澄清石灰水中发生反应,CO2+Ca(OH)2=CaCO3↓+H2O 生成碳酸钙沉淀变浑浊;
故答案为:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)①称取两种固体各2g,分别放入两个小烧杯中,再各滴加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,说明在同样的温度下,同质量的两种固体在同体积的溶剂中,Na2CO3比NaHCO3易溶于水,
故答案为:同温度下,Na2CO3比NaHCO3易溶于水;
②a.碳酸钠溶解过程为放热过程,故a错误;
b.碳酸钠溶解过程放热,温度升高,故b正确;
c.碳酸钠为强碱弱酸盐,水解溶液呈碱性,滴入酚酞后呈红色,故c错误;
d.碳酸钠为强碱弱酸盐,水解溶液呈碱性,碳酸钠俗称纯碱,滴入酚酞后呈红色,故d正确;
故答案为:b、d;
(3)①将气球内的固体同时倒入试管发生反应:Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaHCO3+HCl═NaCl+H2O+CO2↑,同等条件下,碳酸钠与盐酸反应速率不及碳酸氢钠与盐酸反应,所以I的反应程度更为剧烈,
故答案为:Ⅰ;
②a.Na2CO3的摩尔质量为:106g/mol;NaHCO3的摩尔质量为:84g/mol,等质量的Na2CO3和NaHCO3,NaHCO3物质的量较多,生成二氧化碳多,所以装置I的气球体积较大,故a正确;
b.等质量的Na2CO3和NaHCO3,NaHCO3物质的量较多,生成二氧化碳多,故b错误;
c.Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaHCO3+HCl═NaCl+H2O+CO2↑,1g碳酸钠的物质的量为:$\frac{1g}{106g/mol}$=0.0094mol,
1g碳酸氢钠的物质的量为:$\frac{1g}{84g/mol}$=0.012mol,盐酸的物质的量为:0.003mol,盐酸不足,生成气体的体积可根据盐酸计算,故c正确;
d.通过以上计算可知盐酸不足,生成气体的体积可根据盐酸计算,故d错误;
故答案为:a、c;
(4)实验1:碳酸钠能和氯化钙反应CaCl2+Na2CO3═CaCO3↓+2NaCl,离子反应为:Ca2++CO32-=CaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓;
实验2:Ca(OH)2与NaHCO3溶液可发生反应:Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O,离子反应为:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O,
故答案为:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O.
点评 本题考查Na2CO3和NaHCO3性质的异同,题目难度中等,注意把握Na2CO3和NaHCO3性质以及相关反应的方程式的书写,易错点为(4),注意CaCl2与NaHCO3溶液可发生反应:CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O.


科目:高中化学 来源: 题型:选择题
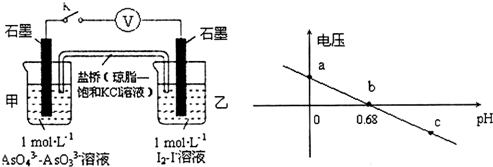
| A. | a点时,盐桥中K+向左移动 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | c点时,正极的电极反应为AsO43-+2H++2e-=AsO33-+H2O | |
| D. | pH>0.68时,氧化性I2>AsO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a | b | c | |
| A | 2 | 1 | 1 |
| B | 1 | 1 | 0 |
| C | 1 | 0 | 1 |
| D | 0 | 1 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ⅠFe(s)+CO2(g)=FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ⅡFe(s)+H2O(g)=FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ⅢCO(g)+H2O(g)=CO2(g)+H2(g) | K3 | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
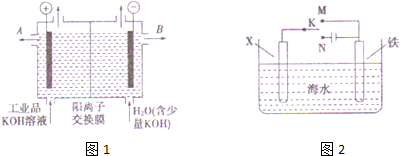
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
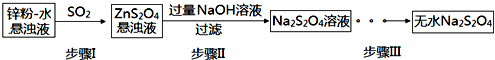
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/h | 0 | 1 | ||
| pH | 4.7 | 4.6 | 4.56 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Br-、CO32- | B. | K+、Na+、SO42-、MnO4- | ||
| C. | Cl-、SO32-、Fe2+、H+ | D. | Na+、H+、NO3-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com