
根据反应 ① 2FeCl3 + 2KI ═ 2FeCl2 + 2KCl + I2, ② 2FeCl2 + Cl2 = 2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是( )
A、Fe3+ >Cl2 >I2 B、Cl2 >I2 >Fe3+
C、I2 >Cl2 >Fe3+ D、Cl2 >Fe3+ >I2
科目:高中化学 来源: 题型:阅读理解
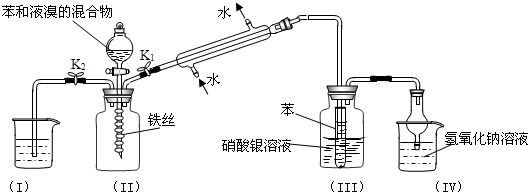
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| △ |
| △ |
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据如图的互变关系,回答下列问题:
根据如图的互变关系,回答下列问题:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
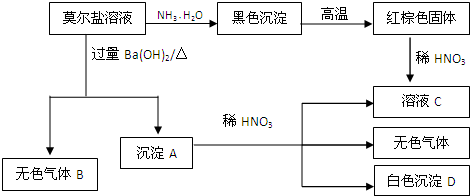
查看答案和解析>>
科目:高中化学 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:058
制取溴化铁可以用下图装置.装置中a是一支瓷管,b是一只套住瓷管的电炉,c是两只耐高温的瓷舟,其中共有典56g的铁粉,d和e中均为液态溴.实验开始时,先将瓷管加热到600-700℃再用干燥的二氧化碳气流将装置中的空气排尽,最后溴从d中慢慢滴入e中,并不断加热,经几个小时后,在瓷管内得到黄绿色的溴化亚铁80g.

(1)如果二氧化碳不干燥,就会发生副反应,写出此反应的化学方程式________.
(2)实验过程中,不断通入二氧化碳主要起两个作用,①________;②________.
(3)根据反应方程式2Fe+3Br2=2FeBr3,2FeBr3=2FeBr2+Br2↑,求这次实验中溴化亚铁的产率是多少________.
(4)为了防止污染空气,装置最后应________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com