
| A. | 标准状况下,11.2 L的三氯甲烷所含的氢原子数为0.5NA | |
| B. | 7.2g丙烯酸分子中含有的双键数为0.2NA | |
| C. | 常温下,3.2g14C18O和16O2的混合物所含中子数为1.8NA | |
| D. | 足量Cu与Imol浓HNO3反应转移电子数目为0.5NA |
分析 A、三氯甲烷是液体不能由体积求物质的量;
B、1mol丙烯酸中含2mol双键;
C、3.2g14C18O和16O2的混合物的物质的量为0.1mol,16O2中子为16个,所以混合物所含中子数小于1.8NA;
D、由反应Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O可知,1mol浓HNO3反应转移电子数目为0.5NA,但随反应的进行浓硝酸变成稀硝酸生成一氧化氮.
解答 解:A、三氯甲烷是液体不能由体积求物质的量,所以无法求氢原子的数目,故A错误;
B、7.2g丙烯酸的物质的量为0.1mol,所以分子中含有的双键数为0.2NA,故B正确;
C、3.2g14C18O和16O2的混合物的物质的量为0.1mol,16O2中子为16个,所以混合物所含中子数小于1.8NA,故C错误;
D、由反应Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O可知,1mol浓HNO3反应转移电子数目为0.5NA,但随反应的进行浓硝酸变成稀硝酸生成一氧化氮,所以转移电子数不是0.5NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.


科目:高中化学 来源: 题型:多选题

| A. | 上述反应的原子利用率可达到100% | |
| B. | 在核磁共振氢谱中对羟基扁桃酸应该有8个吸收峰 | |
| C. | 对羟基扁桃酸可以发生加成反应、取代反应和缩聚反应 | |
| D. | 1 mol对羟基扁桃酸与足量NaOH溶液反应,消耗3mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题:
钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y | |
| B. | 卤族元素的最高正化合价等于其主族序数 | |
| C. | 元素周期表中从ⅢB族到ⅡB族十个纵列的元素都是金属元素 | |
| D. | Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
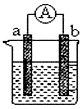 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4F溶液不能存放于玻璃试剂瓶中 | |
| B. | 氮元素的非金属性强于磷,在常温下氮气活泼性也强于磷 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| D. | 二氧化硫和次氯酸的漂白原理不同,二氧化硫漂白时没有发生化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 5 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:Fe3+>Cu2+>Fe2+>Zn2+ | B. | 还原性:Fe3+>Cu2+>Fe2+>Zn2+ | ||
| C. | 氧化性:Zn>Fe>Cu>Fe2+ | D. | 还原性:Zn>Fe>Cu>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
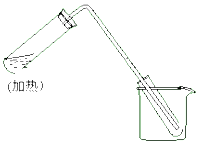 如图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中实验完全相同.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com