
����˵����ȷ����
A��������ȼ����Ϊ285 . 5KJ/mol ������ˮ���Ȼ�ѧ����ʽΪ2H2O(l)  2H2(g)+O2(g) ��H=+285 . 5KJ/mol
2H2(g)+O2(g) ��H=+285 . 5KJ/mol
B����֪H+(aq)+OH-(aq)=H2O(l) ��H= -57 . 3KJ/mol ��ϡH2SO4��Һ��ϡBa(OH)2��Һ��Ӧ�ķ�Ӧ�ȡ�H=2 ��(-57 . 3)KJ/mol
C����CO2�У�Mgȼ������MgO��C���÷�Ӧ�л�ѧ��ȫ��ת��Ϊ����
D����֪AX3���۵�ͷе�ֱ�Ϊһ93 .6���76�棬 AX5���۵�Ϊ167�档����ʱAX3������X2��Ӧ����1 mol AX5���ų�����123.8 KJ/mol���÷�Ӧ���Ȼ�ѧ����ʽΪAX3(l)+ X2(g)= AX5(s) ��H= һ123.8 KJ/mol

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016��㶫ʡ����У������ѧ��12���������ۻ�ѧ�Ծ��������棩 ���ͣ������
��ҵ�ϻ�������ij�Ͻ����(��Ҫ��Fe��Cu��Al��Co��Li�ȣ���֪Co��Fe�����еȻ��ý���)�Ĺ����������£�

��֪��Ksp[Cu(OH)2]=4.0��10��21��Ksp[Al(OH)3]=1.0��10��32��Ksp[Fe(OH)3]=1.0��10��38��Ksp[Fe(OH)2]=8.0��10��19��pH=7.3ʱLi+��Co3+��ʼ������
��1������MΪ ��
��2���ټ���H2O2��������(�����ӷ���ʽ��ʾ) ��
�ڰ�ˮ�������ǵ�����Һ��pH�������£�ʹ��Һ���������Ӹպó�����ȫ��ȫ����ȥ(Ũ��С��1.0��10��5mol��L��1) ���������ҺpH��ΧΪ ��
��3����ֱ��յĻ�ѧ����ʽΪ ��
��4����֪Li2CO3����ˮ���䱥����Һ��Ũ�����¶ȹ�ϵ���±�������2�У�����Ũ���������ȹ��ˣ���ԭ���� ��
�¶�/�� | 10 | 30 | 60 | 90 |
Ũ��/mol?L��1 | 0.21 | 0.17 | 0.14 | 0.10 |
��5���ö��Ե缫�������Li2CO3��ȡﮣ����������������壬�������ĵ缫��ӦʽΪ ��
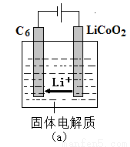
��6������Li��Co�γ�ij����ӵ�ص�������LiCoO2����Li+�������Ϊ����ʡ����ʱ��Li����ԭΪLi������ԭ����ʽǶ���ظ�������̼-6(C6)��(��ͼa)����ط�ӦΪLixC6+Li1-xCoO2 C6+LiCoO2��
C6+LiCoO2��
д���õ�طŵ�ʱ�ĸ�����Ӧʽ___________________________��
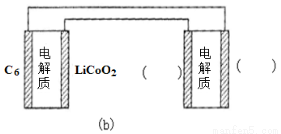
������ص��ܷ�ӦΪ��2Li+S Li2S��ͼb��ʾ������ӵ�ظ�����س�磬����ͼb�ĵ缫( )����д��Li����S�����Դﵽ������س���Ŀ�ġ�
Li2S��ͼb��ʾ������ӵ�ظ�����س�磬����ͼb�ĵ缫( )����д��Li����S�����Դﵽ������س���Ŀ�ġ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ӱ�ʡ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ʵ�鱨���У��������ݺ�������
A���ü�ʽ�ζ�����ȡ25.03mLH2SO4��Һ
B����50mL��Ͳ��ȡ21.48mLϡ����
C����������ƽ��ȡ11.7gNaCl
D����pH��ֽ�ⶨHNO3��Һ��pH=3.7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ�����и�����ѧ��12��ͳ����ѧ�Ծ��������棩 ���ͣ�ѡ����
��ʫ���ǹ���Ϊ�������µı�����Ƹ�������ʫ�䲻�漰������ԭ��Ӧ����
A��Ұ���ղ��������紵����
B�����ϵ���˿����������ɻ���ʼ��
C��������ǻ벻�£�Ҫ��������˼�
D����������һ�����������ů������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����Ͽ�и�����ѧ�ڵڶ��ξ�Ӣ�Կ�����ѧ�Ծ��������棩 ���ͣ�ѡ����
��100mL pH=0�������������Һ��Ͷ��3��84gͭ�ۣ���ʹ��Ӧ�����ɺ�����һ����������448mL(��״��)����Ӧǰ�Ļ����Һ�к���������ʵ���Ϊ
A��0��02mol B��0��08mol C��0��10mol D��0��16mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����Ͽ�и�����ѧ�ڵڶ��ξ�Ӣ�Կ�����ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ������������أ�����˵������ȷ����
A��ú��ʯ�͡���Ȼ���Dz���������Դ�����ܡ��������ܡ������ǿ�������Դ
B����84����Һ������ǿ�����ԣ������������������Ӷ�Ԥ������
C����֪ˮ�ȷ�Ӧ��ָ�ڸ��¸�ѹ�£���������̼ת��Ϊ�л���ļ�������ˮ�ȷ�Ӧ���Խ�����Ȼ����̼�ĺ���
D����֪PM2��5��ָ������ֱ��С�ڻ����2��5�Ŀ����Ҳ��Ϊ��ϸ���������PM2��5�ڿ������п����γɽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ�����и�����ѧ��12�½�ѧ����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ����ȷ����
A����AgCl����Һ�м���Na2S��Һ��2AgCl+S2-=Ag2S+2C1-
B����NaHCO3��Һ�м���NaOH��Һ��HC03һ+OH-=C032-+ H20
C����Ba(OH)2��Һ�м���ϡH2S04:Ba2++ OH-+ H++ S042-=BaS04 ��+H20
D����Cu���м��������ŨHN03:Cu+4H++ 2N03-=Cu2++ 2N02 +2H20
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��㶫ʡ����У������ѧ��12���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ͼ��ʾװ�ý�������ʵ�飬�ܵó���Ӧʵ����۵���
ѡ�� | �� | �� | �� | ʵ����� |
|
A | Ũ���� | Na2CO3 | Na2SiO3��Һ | �ǽ����ԣ�Cl �� C �� Si | |
B | ϡ���� | Na2S | AgNO3��AgCl����Һ | Ksp(AgCl)��Ksp(Ag2S) | |
C | Ũ��ˮ | ��ʯ�� | AlCl3��Һ | Al(OH)3�������������� | |
D | Ũ���� | ���� | ��ˮ | Ũ���������ˮ�ԡ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ��У������ѧ�ڵڶ��ε�Ԫ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ϳɰ���Ӧ:N2(g)+3H2(g)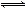 2NH3(g)��H=-92.4 kJ��mol-1,�ڷ�Ӧ������,����Ӧ���ʵı仯��ͼ��ʾ:
2NH3(g)��H=-92.4 kJ��mol-1,�ڷ�Ӧ������,����Ӧ���ʵı仯��ͼ��ʾ:
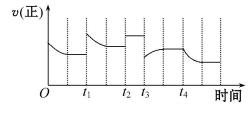
����˵����ȷ����
A��t1ʱ�������¶� B��t2ʱʹ���˴���
C��t3ʱ������ѹǿ D��t4ʱ�������¶�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com