
分析 (1)溶于水或熔融状态下能够电离出阴阳离子的化合物是电解质;溶于水和熔融状态下都不能够电离出阴阳离子的化合物是非电解质;
(2)酸碱中和反应实质是酸电离出的氢离子与碱电离出的氢氧根离子反应;
(3)硫酸铝电离出硫酸根和铝离子,据此解答即可.
解答 解:①Na是金属单质,能导电,既不是电解质也不是非电解质;②NaCl溶液是混合物,能导电,既不是电解质也不是非电解质;③Na2O是金属氧化物,不能导电,但是熔融状态下能导电,属于电解质;④NO2溶液能导电,属于混合物,既不是电解质也不是非电解质;⑤CO2不能导电,属于非电解质;⑥NaOH不能导电,溶于水或熔融状态下能导电,属于电解质;⑦Al2(SO4)3不能导电,溶于水或熔融状态下能导电,属于电解质;⑧HCl不能导电,溶于水能导电,属于电解质;⑨BaSO4不能导电,熔融状态下能导电,属于电解质;⑩蔗糖不能导电,属于非电解质,故答案为:③⑥⑦⑧⑨;⑤⑩;①②④;(2)⑥⑧反应的离子反应方式 H++OH-=H2O,故答案为:H++OH-=H2O;(3)硫酸铝是强电解质,能完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-,1molAl2(SO4)3溶于水配成250mL溶液,SO42-的粒子数为3×6.02×1023=1.806×1024,SO42-的物质的量浓度为3mol÷0.25L=12mol/L,故答案为:Al2(SO4)3=2Al3++3SO42-; 3mol;1.806×1024,12mol/L.
点评 本题主要考查了电解质与非电解质的概念、粒子的导电性,题目难度不大,注意电解质和导电性的关系,导电的不一定是电解质,电解质不是任何条件下都导电.


科目:高中化学 来源: 题型:选择题
| A. | 放热反应,熵增加 | B. | 放热反应,熵减小 | C. | 吸热反应,熵增加 | D. | 吸热反应,熵减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
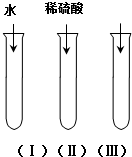 氧化铜(CuO)是一种黑色固体,可溶于稀硫酸中.某同学想知道是稀硫酸中的H2O、H+和SO42-中的哪种粒子能使氧化铜溶解.请你和他一起通过如图所示三个实验来完成这次探究活动.
氧化铜(CuO)是一种黑色固体,可溶于稀硫酸中.某同学想知道是稀硫酸中的H2O、H+和SO42-中的哪种粒子能使氧化铜溶解.请你和他一起通过如图所示三个实验来完成这次探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 观察颜色 | B. | 滴一滴硝酸在币的表面,观察现象 | ||
| C. | 用手掂量轻重 | D. | 查看图案 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaCl溶液表示的是1L溶剂中溶解0.1mol NaCl的溶液 | |
| B. | 将0.1mol氧化钠溶于水并配成1L溶液,则溶液的物质的量浓度为0.1mol•L-1 | |
| C. | 物质的量浓度和溶质质量分数均是表示溶液组成的物理量 | |
| D. | 0.1mol•L-1的CaCl2溶液中c(Cl-)也为0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com