
【题目】Ⅰ.CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2 4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是______________。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_______
Ⅱ.氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。完成下列计算:
(5)CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2_______L(标准状况)。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为_______mol。
(6)已知粗盐水含MgCl2 6.80 mol/m3,含CaCl2 3.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2然后加入Na2CO3除钙离子。处理上述粗盐水10 m3,至少需要加Na2CO3______g。如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2+ + 2NH3 + CO2 + H2O → CaCO3↓ + 2NH4+处理上述10 m3粗盐水至少需要通入_____________L(标准状况)碳酸化尾气。
(7)某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。
①过滤后溶液中氯化钠的质量______________。
②析出的碳酸氢钠晶体的质量__________________。
【答案】89.6 2.4 mol/L≥c≥1.2 mol/L 3(mol) 80% 20160L 400 10388 54880L 351kg 1680kg
【解析】
Ⅰ.(1)NH4HCO3完全分解生成NH3、CO2,方程式为NH4HCO3![]() NH3↑+CO2↑+H2O,分解后水为液态,则2molNH4HCO3可生成4mol气体,体积为4mol×22.4L/mol=89.6L,故答案为:89.6。
NH3↑+CO2↑+H2O,分解后水为液态,则2molNH4HCO3可生成4mol气体,体积为4mol×22.4L/mol=89.6L,故答案为:89.6。
(2)2.40molCO2与NaOH完全反应,产物可能为Na2CO3或NaHCO3或二者都有,假设全部生成生成NaHCO3,则发生CO2+NaOH=NaHCO3,n(NaOH)=n(CO2)=2.40mol,则c(NaOH)=2.4mol/2.00L=1.20mol/L;假设全部生成,则发生CO2+2NaOH=Na2CO3,n(NaOH)=2n(CO2)=4.80mol,则c(NaOH)=4.80mol/2.00L=2.40mol/L;综合以上两种情况可知,NaOH溶液的浓度应该1.20mol/L≤c(NaOH)≤2.40mol/L,故答案为:2.4mol/L≥c≥1.2mol/L。
(3)依题意,9 molCO2在密封舱内和KO2反应后生成9 mol O2,即n(CO2):n(O2)=1:1,通过观察题给两个方程式可知,当把两个方程式相加时正好符合题目要求:8KO2+6CO2+2H2O→2K2CO3+4KHCO3+6O2,所以有n(H2O)=1313n(CO2)=1313×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol,故答案为:3mol。
(4)在合成甲醇的反应中,氢元素在生成物中有两种存在形式,一是存在于甲醇中,二是存在于水中,设CO2的转化率为α,
CH4+H2O→CO+3H2
300mol 900mol
CO2+3H2→CH3OH+H2O
100amol 100amol
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-120mol,根据反应中氢元素的守恒可有900mol-120mol=350mol×2+100amol,解得a=0.8,即设CO2的转化率为80%,故答案为:80%。
Ⅱ.(5)CaCO3分解的反应方程式是:CaCO3![]() CaO+CO2↑,根据方程式可知每1molCaCO3反应会产生1molCO2,质量分数为0.90的石灰石100kg物质的量是n(CaCO3)=(1.0×105g×0.90)÷100g/mol=900mol,则石灰石完成分解产生标准状况下的CO2的体积是V(CO2)=nVm=900mol×22.4L/mol=20160L。石灰窑中,该石灰石100kg与焦炭混合焙烧,产生标准状况下CO229120L,如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭燃烧产生的CO2的体积是V(CO2)=V(总)-V(石灰石)=29120L-20160L=8960L,则其物质的量是n(CO2)=V(CO2)÷Vm=8960L÷22.4L/mol=400mol。根据碳元素守恒,可知焦炭的物质的量与产生的物质的量CO2相等,也是400mol,故答案为:20160L,400。
CaO+CO2↑,根据方程式可知每1molCaCO3反应会产生1molCO2,质量分数为0.90的石灰石100kg物质的量是n(CaCO3)=(1.0×105g×0.90)÷100g/mol=900mol,则石灰石完成分解产生标准状况下的CO2的体积是V(CO2)=nVm=900mol×22.4L/mol=20160L。石灰窑中,该石灰石100kg与焦炭混合焙烧,产生标准状况下CO229120L,如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭燃烧产生的CO2的体积是V(CO2)=V(总)-V(石灰石)=29120L-20160L=8960L,则其物质的量是n(CO2)=V(CO2)÷Vm=8960L÷22.4L/mol=400mol。根据碳元素守恒,可知焦炭的物质的量与产生的物质的量CO2相等,也是400mol,故答案为:20160L,400。
(5)10m3粗盐水中含有的MgCl2、CaCl2物质的量是:n(MgCl2)=6.80mol/m3×10m3=68mol;n(CaCl2)=3.00mol/m3×10m3=30mol。根据反应方程式MgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2可知1molMgCl2发生反应被除去时引入1molCaCl2。则向粗盐水中加入Ca(OH)2除镁离子后得到的溶液中含有的CaCl2的物质的量是:68mol+30mol=98mol,根据反应方程式:Na2CO3+CaCl2=CaCO3↓+2NaCl可知反应消耗Na2CO3的物质的量与CaCl2的物质的量相等,则其质量是m(Na2CO3)=nM=98mol×106g/mol=10388g。根据反应方程式Ca2++2NH3+CO2+H2O→CaCO3↓+2NH4+可知反应消耗的氨气与CO2的物质的量的比是2:1,而混合气体中含NH3体积分数为0.100、CO2体积分数0.040,说明NH3过量,不能完全反应,应该以不足量的CO2为标准进行计算,而n(Ca2+)=n(CO2),n(Ca2+)=98mol,则需要n(CO2)=98mol,混合气体的物质的量是n(混合)=98mol÷0.04=2450mol,其在标准状况下的体积是V(混合)=nVm=2450mol×22.4L/mol=54880L,故答案为:10388,54880。
(7)①n(NaCl)(总)=m÷M=1521000g÷58.5g/mol=26000mol,反应产生的NH4Cl的物质的量是n(NH4Cl)=m÷M=1070000g÷53.5g/mol=20000mol,根据氯元素守恒可知,在溶液中含有的NaCl的物质的量是n(NaCl)=n(NaCl)(总)-n(NH4Cl)=26000mol-20000mol=6000mol,其质量是m(NaCl)=nM=6000mol×58.5g/mol=351000g=351kg,故答案为:351。
②氨盐水中发生反应根据反应方程式:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。产生的NaHCO3的物质的量与NH4Cl的物质的量相等,则析出的碳酸氢钠晶体的质量是m(NaHCO3)=nM=20000mol×84g/mol=1680000g=1680kg,故答案为:1680。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
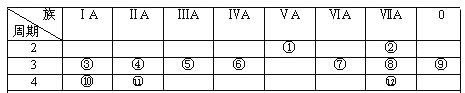
(1)写出下列元素符号:①________,⑥________,⑦________,________。
(2)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是_______,最不活泼的元素是________。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是______,呈两性的氢氧化物是___________,写出三者之间相互反应的化学方程式___。
(4)在这些元素中,原子半径最小的是_________,原子半径最大的是_________。
(5)在③与④中,化学性质较活泼的是________,怎样用化学实验证明?答:________。在⑧与中,化学性质较活泼的是_________,怎样用化学实验证明?答:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定质量的锌粒与稀盐酸反应,生成H2的浓度与反应时间的关系如图所示,下列结论不正确的是

A.若将锌粒改为锌粉,可加快产生H2的反应速率
B.反应前4min内温度对反应速率的影响比浓度大
C.反应开始2min内平均反应速率最大
D.反应前4min内生成H2的平均速率v(H2)=0.09mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 向稀HNO3中滴加NaHSO3溶液:H++HSO![]() ===SO2↑+H2O
===SO2↑+H2O
B. 硫酸铝溶液中加入过量氨水:Al3++3OH-===Al(OH)3↓
C. 向含有2 mol FeI2的溶液中通入2.5 mol Cl2:8I-+2Fe2++5Cl2===10Cl-+4I2+2Fe3+
D. 用酸性高锰酸钾标准溶液滴定草酸:2MnO![]() +16H++5C2O
+16H++5C2O![]() ===2Mn2++10CO2↑+8H2O
===2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种新型消毒剂,可用氯酸钠(NaClO3)为原料制备。
(1)隔膜电解法制备ClO2的装置示意图如下:
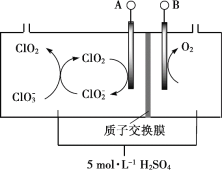
已知:ClO2在酸性溶液中比较稳定,在碱性溶液中不能稳定存在。
①产生O2的电极反应式:________。
②结合反应方程式,简述ClO2的产生过程:_________。
(2)过氧化氢还原法制备ClO2:![]() 研究发现Cl-对上述反应有影响,实验记录如下:
研究发现Cl-对上述反应有影响,实验记录如下:
加入NaCl 的浓度/(g·L1) | ClO2的生成速率/(g·L-1·min-1) | 相同时间 | |||
10 min | 30 min | 60 min | ClO2 产率/% | Cl2 的量 | |
0 | 0.0035 | 0.0124 | 0.0159 | 97.12 | 极微量 |
1.00 | 0.0138 | 0.0162 | 0.0163 | 98.79 | 极微量 |
①NaCl的主要作用是_______。
②上述反应可能的过程如下:
反应i:![]() +
+ ![]() + +
+ +
反应ii: Cl2 + H2O2 = 2Cl- + O2↑ + 2H+
将反应i填写完整_________。
③进一步研究发现,未添加Cl-时,体系中首先会发生反应生成Cl-,反应为:ClO3- + 3H2O2 = Cl- + 3O2↑+3H2O(反应iii)。分析反应i、ii、iii的速率大小关系并简要说明理由:_________。
(3)国家规定,饮用水中ClO2的残留量不得高于0.8 mg·L-1,检测步骤如下:
Ⅰ.取1.0L的酸性水样,加入过量的碘化钾,再用氢氧化钠溶液调至中性,使ClO2转化为![]() 。加入淀粉溶液,溶液变蓝。
。加入淀粉溶液,溶液变蓝。
Ⅱ.用0.0010 mol/LNa2S2O3溶液滴定步骤I中产生的I2。已知:步骤II中发生反应的离子方程式是![]()
①步骤I中发生的氧化还原反应的离子方程式是________。
②当步骤II中出现________(填现象)时,停止滴加Na2S2O3溶液,记录其体积为10.00 mL。
③上述水样中ClO2的残留浓度是______mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝合金3.9g溶于200mL2mol·L1的盐酸,在标准状况下放出气体的体积为4.48L。向反应后的溶液中加入足量氨水,产生沉淀的质量为( )
A.3.9gB.9.0gC.10.7gD.12.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并进行相关性质实验的装置(夹持及加热仪器已略)。

回答下列问题:
(1)仪器①中盛有的固体药品是___。
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl气体,同时装置B还可监测实验进行时C中是否发生堵塞,若发生堵塞时B中的现象为___。
(3)装置C的目的是验证氯气是否具有漂白性,II中试剂的作用是___。对比I和III中的现象可得出的结论是___。
(4)该实验设计的缺陷是___,改进的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,在下列转化关系中,甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物。其中A为d元素组成的单质,常温下乙为液体,丁物质常用于消毒、漂白。下列说法错误的是
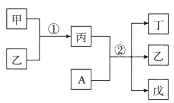
A.简单离子半径:c>b
B.丙中既有离子键又有极性键
C.b、c形成的化合物中阴、阳离子数目比为1:2
D.a、b、d形成的化合物中,d的杂化方式是sp3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。

(1)在上图构想的物质和能量循环中太阳能最终转化为____________能。
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g)![]() 2CH3OH(g)+3O2(g)。
2CH3OH(g)+3O2(g)。
一定条件下,在2 L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
①用CH3OH表示0~3 min内该反应的平均反应速率为______________________。
②能说明该反应已达到平衡状态的是_______________。
a.v正(H2O)=2v逆(CO2) b.n(CH3OH):n(O2)=2:3
c.容器内密度保持不变 d.容器内压强保持不变
(3)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如表。

①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加____________助剂效果最好;
②加入助剂能提高单位时间内乙烯产量的根本原因是____________。
(4)用人工光合作用得到的甲醇、氧气和稀硫酸制作电池,则甲醇应通入该电池的____极(填“正”或“负”),溶液中的H+流向该电池的____极(填“正”或“负”)通入氧气的一极的电极反应式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com