
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
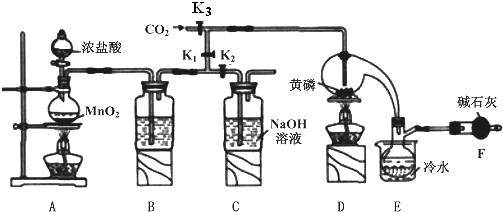
分析 实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应.
(1)氯气为酸性气体,需用酸性干燥剂干燥,三氯化磷沸点低,可用冷水冷凝收集;
(2)碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度;
(3)白磷能自燃,通入二氧化碳赶净空气;
(4)依据物质的沸点数值不同,可以利用蒸馏的方法分离出三氯化磷;
(5)氢氧化钠与氯气反应生成氯化钠和次氯酸钠;
(6)依据反应的化学方程式H3PO3+H2O+I2=H3PO4+2HI、I2+2Na2S2O3=2NaI+Na2S4O6 可知n(H3PO3)=n(I2)总-n(Na2S2O3)×$\frac{1}{2}$,25mL溶液中H3PO3的物质的量等于三氯化磷的物质的量,再求出三氯化磷的总物质的量和质量,然后求出质量分数.
解答 解:实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,K3利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应.
(1)因PCl3遇水会强烈水解,所以氯气需干燥,氯气和浓硫酸不反应,所以能用浓硫酸干燥氯气,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),
故答案为:浓硫酸;冷凝PCl3防止其挥发;
(2)因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应,
故答案为:吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3 反应;
(3)通入一段时间的CO2可以排尽装置中的空气,防止白磷与空气中的氧气发生自燃;
故答案为:排尽装置中的空气,防止白磷自燃;
(4)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离,
故答案为:蒸馏;
(5)氢氧化钠与氯气反应生成氯化钠和次氯酸钠:Cl2+2OH-=Cl-+ClO-+2H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+2H2O;
(6)0.1000mol•L-1碘溶液10.00mL中含有碘单质的物质的量为:0.1000mol•L-1×0.0100L=0.00100mol,根据反应I2+2Na2S2O3=2NaI+Na2S4O6可知,与磷酸反应消耗的碘单质的物质的量为:0.00100mol-0.1000mol•L-1×0.00084L×$\frac{1}{2}$=0.00058mol,再由H3PO3+H2O+I2=H3PO4+2HI可知,25mL三氯化磷水解后的溶液中含有的H3PO3的物质的量为:n(H3PO3)=n(I2)=0.00058mol,250mL该溶液中含有H3PO3的物质的量为:0.00058mol×$\frac{250mL}{25mL}$=0.0058mol,所以1.00g产品中含有的三氯化磷的物质的量为0.0058mol,该产品中PCl3的质量分数为:$\frac{137.5g/mol×0.0058mol}{1g}$×100%=79.75%;
故答案为:79.75%.
点评 本题考查阅读获取信息的能力、对实验原理理解等,题目难度较大,是对知识的综合运用,理解实验原理是解题的关键,需要学生具有扎实的基础与综合运用分析解决问题的能力,注意题中信息PCl3遇O2会生成POCl3,POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.


科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量固体NaHSO4,c(H+)增大,KW不变 | |
| B. | 向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)减小 | |
| C. | 向水中加入少量冰醋酸,平衡正向移动,c(H+) 增大 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 说明原溶液中一定含有FeCl3 | |
| B. | H3PO3+2NaOH(足量)=Na2HPO3+2H2O,H3PO3属于三元酸 | |
| C. | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀酸雨中一定含有SO42- | |
| D. | CaO$\stackrel{H_2{O}}{→}$Ca(OH)2$\stackrel{Na_{2}CO_{3}}{→}$NaOH 用生石灰制备NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A. | 该反应为放热反应 | |
| B. | 可测量容器总压变化来判定化学反应是否达到平衡 | |
| C. | 若在某平衡状态时,c(CO2)×c(H2)=c(CO)×c(H2O),此时的温度为830℃ | |
| D. | 达平衡时,浓度:c(CO2)=c(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{Kw}{c(H+)}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| B. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| C. | 含有NaClO的溶液中:H+、NH4+、SO42-、Br- | |
| D. | 水电离出的c(H+)=1×10-13mol•L-1的溶液中:NH4+、Na+、AlO2-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com