
����(COCl2)�����ϡ��Ƹ��ҩ�ȹ�ҵ����������;����ҵ�ϲ��ø�����CO��Cl2�ڻ���̿���ºϳɡ�
��1��������ҵ����Դ���ȼҵ���ȼҵ�Ļ�ѧ����ʽΪ
��2����ҵ��������Ȼ��(��Ҫ�ɷ�ΪCH4)��CO2���и��������Ʊ�CO��H2����֪CH4��H2��CO��ȼ����(��H)�ֱ�Ϊ��890.3 kJ/mol����285.8kJ/mol�ͣ�283.0 kJ/mol����÷�Ӧ���Ȼ�ѧ����ʽΪ��_____ _____��
��3��COCl2�ķֽⷴӦΪCOCl2(g)  Cl2(g) + CO(g) ��H =" +108" kJ/mol����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͼ��ʾ(��10 min��14 min��COCl2Ũ�ȱ仯������ʾ��)��
Cl2(g) + CO(g) ��H =" +108" kJ/mol����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͼ��ʾ(��10 min��14 min��COCl2Ũ�ȱ仯������ʾ��)��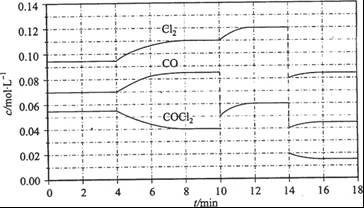
�ټ��㷴Ӧ�ڵ�8 minʱ��ƽ�ⳣ��K = __________(����С�������λ����)
�ڱȽϵ�2 min��Ӧ�¶�T��2�����8 min��Ӧ�¶�(T8)�ĸߵͣ�T��2��____T��8��(�<���� ��>����=��)��
����12 minʱ��Ӧ���¶�T��8�������´ﵽƽ�⣬���ʱc(COCl2) = ______mol/L��
�ܱȽϲ���CO��2��3 min��5��6 min��12��13 minʱƽ����Ӧ����[ƽ����Ӧ���ʷֱ���V(2��3)�� V(5��6)�� V(l2��13)��ʾ]�Ĵ�С____________��
�ݷ�Ӧ��COCl2��5��6 min��15��16 minʱƽ����Ӧ���ʵĴ�СΪ��V(5��6) > V(15��16)��ԭ����__ _____________��
��1��2NaCl+2H2O 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
��2��CH4(g)+CO2(g)��2CO(g)+2H2(g) ��H="+247.3kJ/mol"
��3�� ��0.23 ��< ��0.031 ��V(5��6) > V(2��3)= V(l2��13)
������ͬ�¶�ʱ���÷�Ӧ�ķ�Ӧ��Ũ��Խ�ߣ���Ӧ����Խ��
���������������1���ȼҵ�ǵ�ⱥ��ʳ��ˮ���Ʊ��������ȼҵ�Ļ�ѧ����ʽΪ2NaCl+2H2O 2NaOH+H2��+Cl2������2�����ݸ�˹���ɣ��ɵ�CH4(g)+CO2(g)��2CO(g)+2H2(g) ��H=+247.3kJ/mol����3������ͼ��֪��8minʱCOCl2��ƽ��Ũ��Ϊ0.04mol/L��Cl2��ƽ��Ũ��Ϊ0.11mol/L��CO��ƽ��Ũ��Ϊ0.085mol/L���ʸ��¶��»�ѧƽ�ⳣ��k=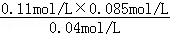 ="0.234" mol?L��1���ڵ�8minʱ��Ӧ���Ũ�ȱȵ�2minʱ��С��������Ũ������ƽ��������Ӧ�����ƶ���4min˲��Ũ�Ȳ��䣬������Ϊ�ı�ѹǿ��Ũ�ȣ�Ӧ�Ǹı��¶ȣ�����Ϊ����ӦΪ���ȷ�Ӧ������T��2����T��8�����ʴ�Ϊ����������ͼ��֪��10min˲��Cl2Ũ������CO��Ũ�Ƚ��ͣ��ʸı�����Ϊ����CO������CO��Ũ�ȣ�ƽ�ⳣ�����䣬��8min����ƽ��ʱ��ƽ�ⳣ����ͬ����ͼ��֪��12minʱ����ƽ��ʱCl2��ƽ��Ũ��Ϊ0.12mol/L��CO��ƽ��Ũ��Ϊ0.06mol/L���ʣ�
="0.234" mol?L��1���ڵ�8minʱ��Ӧ���Ũ�ȱȵ�2minʱ��С��������Ũ������ƽ��������Ӧ�����ƶ���4min˲��Ũ�Ȳ��䣬������Ϊ�ı�ѹǿ��Ũ�ȣ�Ӧ�Ǹı��¶ȣ�����Ϊ����ӦΪ���ȷ�Ӧ������T��2����T��8�����ʴ�Ϊ����������ͼ��֪��10min˲��Cl2Ũ������CO��Ũ�Ƚ��ͣ��ʸı�����Ϊ����CO������CO��Ũ�ȣ�ƽ�ⳣ�����䣬��8min����ƽ��ʱ��ƽ�ⳣ����ͬ����ͼ��֪��12minʱ����ƽ��ʱCl2��ƽ��Ũ��Ϊ0.12mol/L��CO��ƽ��Ũ��Ϊ0.06mol/L���ʣ�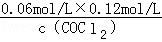 =0.234mol/L�����c��COCl2��=0.031mol/L���ʴ�Ϊ��0.031������5��6 min��15��16 minʱ��Ӧ�¶���ͬ������ͬ�¶�ʱ���÷�Ӧ�ķ�Ӧ��Ũ��Խ�ߣ���Ӧ����Խ��15��16 minʱ����ֵ�Ũ�ȶ�С����˷�Ӧ����С����v��5��6����v��15��16����V(5��6) > V(2��3)= V(l2��13)��������ͬ�¶�ʱ���÷�Ӧ�ķ�Ӧ���Ũ��Խ�ߣ���Ӧ����Խ��
=0.234mol/L�����c��COCl2��=0.031mol/L���ʴ�Ϊ��0.031������5��6 min��15��16 minʱ��Ӧ�¶���ͬ������ͬ�¶�ʱ���÷�Ӧ�ķ�Ӧ��Ũ��Խ�ߣ���Ӧ����Խ��15��16 minʱ����ֵ�Ũ�ȶ�С����˷�Ӧ����С����v��5��6����v��15��16����V(5��6) > V(2��3)= V(l2��13)��������ͬ�¶�ʱ���÷�Ӧ�ķ�Ӧ���Ũ��Խ�ߣ���Ӧ����Խ��
���㣺���⿼�黯ѧ����ʽ���Ȼ�ѧ����ʽ����д�ͻ�ѧƽ��ͼ����йؼ��㡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ԴΣ���ǵ�ǰȫ�����⣬��Դ������Ӧ����ԴΣ������Ҫ�ٴ롣
(1)����������������Դ����Դ����������________(�����)��
a��������չũ���������������Ľո�ת��Ϊ����Ч����Դ
b����������ú��ʯ�ͺ���Ȼ������������������������Դ����
c������̫���ܡ�ˮ�ܡ����ܡ������ܵ�����Դ������ʹ��ú��ʯ�͵Ȼ�ʯȼ��
d��������Դ���ģ�������Դ���ظ�ʹ�á���Դ��ѭ������
(2)���ʯ��ʯī��Ϊ̼��ͬ�������壬����ȼ����������ʱ����һ����̼�����ȼ�����ɶ�����̼����Ӧ�зų���������ͼ��ʾ��
����ͨ��״���£����ʯ��ʯī��________(����ʯ����ʯī��)���ȶ���ʯī��ȼ����Ϊ________��
��12 gʯī��һ����������ȼ�գ���������36 g���ù��̷ų�������________��
(3)��֪��N2��O2�����л�ѧ���ļ��ֱܷ���946 kJ��mol��1��497 kJ��mol��1��
N2(g)��O2(g)=2NO(g)����H��180.0 kJ��mol��1��
NO�����л�ѧ���ļ���Ϊ________kJ��mol��1��
(4)�ۺ������й���Ϣ����д��CO��NO��Ӧ���Ȼ�ѧ����ʽ_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����ʵ��Ļ�ѧ������ա�
��1��Na2CO3ˮ������ӷ���ʽ�� ��
��2��H2S���뷽��ʽ�� ��
��3��AlCl3ˮ������ӷ���ʽ�� ��
��4����25�桢101 kPa�£�l g������ȫȼ������CO2��Һ̬ˮʱ����55��6 kJ������д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
��5����������ȼ�ϵ�ص������缫����ʽ
������ ��
������ ��
��6��д��NaHCO3��Һ�е�����Ũ�ȹ�ϵ
c(H+)+c(Na+)= ��
c(Na+)= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ͭ���ʼ��仯�����ڹ�ҵ�����Ϳ���������Ҫ���á�
��1����֪��2Cu2O(s) + O2(g) = 4CuO(s)��H����292kJ��mol��1
2C(s)+O2(g)=2CO(g) ��H����221kJ��mol��1
��д��������̿�ۻ�ԭCuO��s���Ʊ�Cu2O��s�����Ȼ�ѧ����ʽ�� ��
��2�������Ȼ�ͭ����(CuCl2��2H2O�����Ȼ���������)��ȡ������CuCl2��2H2O���Ƚ����Ƴ�ˮ��Һ������ͼ��������ᴿ: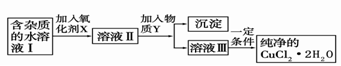
��֪Cu2+��Fe3+��Fe2+���������↑ʼ�����ͳ�����ȫʱ��pH���±�
| �������� | Fe3+ | Fe2+[��Դ:ѧ&��& | Cu2+ |
| �������↑ʼ����ʱ��pH | 1.9 | 7.0 | 4.7 |
| ����������ȫ����ʱ��pH | 3.2 | 9.0 | 6.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��15�֣���Դ�����ö�����̼�����ɼ�������������ŷţ��������»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��1����CO2��NH3Ϊԭ�Ͽɺϳɻ�������[CO(NH2)2]����֪��
��2NH3��g���� CO2��g���� NH2CO2NH4��s�� ��H �� -159.47 kJ��mol-1
��NH2CO2NH4��s���� CO(NH2)2��s���� H2O��g�� ��H �� +116.49 kJ��mol-1
��H2O��l���� H2O��g�� ��H ��+88.0 kJ��mol-1
��д��NH3��CO2�ϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽ ��
��2����һ�������£�������̼ת��Ϊ����ķ�Ӧ���£�
CO2(g)+4H2(g) CH4(g)+2H2O(g) ��H��0
CH4(g)+2H2O(g) ��H��0
����һ�ݻ�Ϊ2L�ĺ����ܱ������г���һ������CO2��H2����300��ʱ����������Ӧ���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�ΪCO2��0.2mol��L��1��H2��0.8mol��L��1��CH4��0.8mol��L��1��H2O��1.6mol��L��1����ʼ����CO2��H2�����ʵ����ֱ�Ϊ �� ��CO2��ƽ��ת����Ϊ ��
������������ͬ�ĺ��ݾ��ȣ������û�������������ܱ�����I��II����I�г���1 molCO2,��4 molH2����II�г���1 mol CH4��2 mol H2 O(g) ��300���¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ���� ������ĸ����
| A������I��II������Ӧ������ͬ |
| B������I��II��CH4�����ʵ���������ͬ |
| C������I��CO2�����ʵ���������II�еĶ� |
| D������I��CO2��ת����������II��CH4��ת����֮��С��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
Ӧ�û�ѧ��Ӧԭ��֪ʶ�����������
��1��ij�¶��´�ˮ��c ��H+�� = 2.0��10-7 mol��L-1����˴�ˮ�е�c ��OH-�� = ��
��2����ijCH3COOH��Һϡ��10������ϡ�ͺ����Һ��c��H+�� ԭ����ʮ��֮һ������ڡ�����С�ڡ����ڡ�����
��3��0.1 mol��L-1��������Һ��HCl����CH3COOH����CH3COONa����FeCl3����NaOH������pH������ ������ţ���ʵ�������Ƶ��Ȼ�����Һ�������Ե�ԭ�� �������ӷ���ʽ��ʾ����
��4��һ��������22g������̼����������������Ӧ������̬�״���CH3OH����ˮ����ʱ���ų�247.5kJ�������䷴Ӧ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
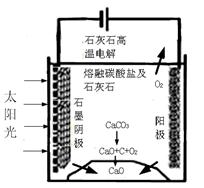
��Դ����Լ���ҷ�չ���̵�����֮һ���״��������ѵȱ���Ϊ2 1���͵���ɫ��Դ����ҵ��������Ȼ��Ϊ��Ҫԭ���������̼��ˮ������һ���������Ʊ��ϳ�����CO��H2�������Ƴɼ״��������ѡ�
��1����ҵ�ϣ����Է���ϳ����е����������ںϳɰ������ô����������ͭ
[Cu��NH3��2Ac]��Һ��Ac=CH3COO�����������պϳ����е�һ����̼���䷴��ԭ��Ϊ��
[Cu��NH3��2Ac]��aq��+CO+NH3 [Cu��NH3��3]Ac?CO��aq������H��0��
[Cu��NH3��3]Ac?CO��aq������H��0��
��ѹ�£�������һ����̼����Һ�������»��[Cu��NH3��2]AC��Һ�Ĵ�ʩ�� ��
��2����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧa��CO2��g��+3H2��g�� CH3OH��g��+H2O��g�� ��H����49.0kJ/mol
CH3OH��g��+H2O��g�� ��H����49.0kJ/mol
��Ӧb��CO��g��+2H2��g�� CH3OH��g�� ��H<0
CH3OH��g�� ��H<0
�ٶ��ڷ�Ӧa��ij�¶��£���4.0 mol CO2��g����12.0 mol H2��g�������ݻ�Ϊ2L���ܱ������У���Ӧ����ƽ��ʱ����ü״��������������Ϊ30%������¶��·�Ӧ��ƽ�ⳣ��Ϊ ��
�ڶ��ڷ�Ӧb��ij�¶��£���1.0mol CO��g����2��0 mol H2��������̶��ݻ����ܱ������У���Ӧ����ƽ��ʱ���ı��¶Ⱥ�ѹǿ��ƽ����ϵ��CH3OH�����ʵ��������仯�����ͼ��ʾ���¶Ⱥ�ѹǿ�Ĺ�ϵ�ж���ȷ���� ��������ĸ���ţ�
A��p3>p2��T3>T2
B��p2>p4��T4>T2
C��p1>p3��T1>T3
D��p1>p4��T2>T3
��3��CO���Ժϳɶ����ѣ������ѿ�����Ϊȼ�ϵ�ص�ԭ�ϣ���ѧ��Ӧԭ��Ϊ��
CO��g��+4H2��g�� CH3OCH3��g��+H2O��g�� ��H<0
CH3OCH3��g��+H2O��g�� ��H<0
���ں����ܱ������ﰴ�����Ϊ1:4����һ����̼��������һ�������·�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ��������Ӧ�����ƶ����� ��
A���淴Ӧ������������С
B������Ӧ������������С
C����Ӧ�������ٷֺ�����С
D����ѧƽ�ⳣ��Kֵ����
��д�������Ѽ���ȼ�ϵ�صĸ����缫��Ӧʽ ��
�ۼ�֪����缫��Ӧ�ĵ缫���ϵ�λ�����ų����ܵĴ�С��Ϊ�õ�صı����������ڶ����Ѽ���ȼ�ϵ�����Ҵ�����ȼ�ϵ�أ�����˵����ȷ���� ������ĸ��
A������ȼ�ϻ�Ϊͬ���칹�壬����ʽ��Ħ��������ͬ����������ͬ
B������ȼ���������ۼ���Ŀ��ͬ���ϼ�ʱ����������ͬ����������ͬ
C������ȼ���������ۼ����Ͳ�ͬ���ϼ�ʱ����������ͬ����������ͬ
��4����֪l g������������ȫȼ�������ȶ���������ų�������Ϊ31.63 kJ����д����ʾ������ȼ���ȵ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ǵ����Ϻ�����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺
��1����ͼ��1 mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ ��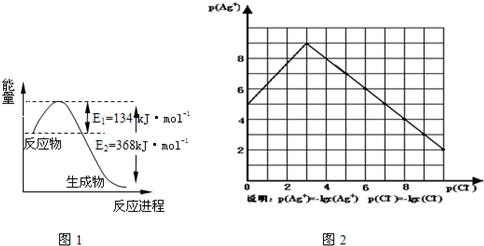
��2����0.5L���ܱ������У�һ�����ĵ����������������»�ѧ��Ӧ��N2(g)+3H2(g)  2NH3(g)��H<0�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���ұ���������������⣻
2NH3(g)��H<0�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���ұ���������������⣻
| t/�� | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
 N2(g)+3H2(g)�Ļ�ѧƽ�ⳣ����ֵΪ �������NH3��N2��H2�����ʵ����ֱ�Ϊ3mol��2mol��1molʱ����÷�Ӧ��v��N2���� __ v��N2��������д��>������=����<��=��
N2(g)+3H2(g)�Ļ�ѧƽ�ⳣ����ֵΪ �������NH3��N2��H2�����ʵ����ֱ�Ϊ3mol��2mol��1molʱ����÷�Ӧ��v��N2���� __ v��N2��������д��>������=����<��=���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����������һ�ֽྻ����������Դ����������(��Ҫ�ɷ�Ϊ CO��CO2��H2��)��H2��ϣ����ϳɼ״��Ͷ����ѣ�CH3OCH3���������������ʵȣ��������������õķ���֮һ.
��1����֪̼��������Ӧ�ڲ�ͬ�¶���ƽ�ⳣ���Ķ���ֵ��lgK�����±�: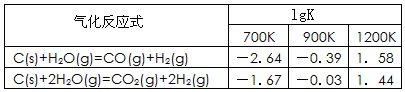
��Ӧ��CO(g)+H2O(g) CO2(g)+H2(g)���÷�Ӧ�ġ�H________0��ѡ�����������������������������900Kʱ���÷�Ӧƽ�ⳣ���Ķ���ֵ��lgK��=_____________.
CO2(g)+H2(g)���÷�Ӧ�ġ�H________0��ѡ�����������������������������900Kʱ���÷�Ӧƽ�ⳣ���Ķ���ֵ��lgK��=_____________.
��2���״���һ����Ҫ����Դ�ͻ���ԭ�ϣ���ҵ�Ϻϳɼ״��ķ�ӦΪ��CO+2H2?CH3OH������֪��H2(g)��CO(g)��CH3OH(l)��ȼ���Ȧ�H�ֱ�Ϊ-285.8KJ/mol��-283.0KJ/mol��-726.5KJ/mol����CH3OH����ȫȼ������CO��Һ̬H2O���Ȼ�ѧ��Ӧ����ʽ .
��3����һ���¶ȡ�ѹǿ�ʹ������£���ҵ����CO��H2��Ӧ���ɶ����ѣ�ͬʱ����һ�ֲ������ѭ���������÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ�� ��
��4����ͼ��Ϊ��ɫ��Դ��������ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��a�缫�Ϸ�����Ӧ�ĵ缫��ӦʽΪ .
��5��������ͼ��װ�õĵ�ԴΪ��4�����еĶ�����ȼ�ϵ�ء���ͨ��Դһ��ʱ��۲쵽װ���е������Һ��ɫ����ɫ��Ϊ��ɫ����������װ���е�Cu�缫Ӧ�������ȼ�ϵ���� �缫����a��b��������ͨ��ʱ������Ӧ���ܵ����ӷ�Ӧ����ʽΪ�� .
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com