
下列说法不正确的是()
①将CO2通入BaCl2溶液中,始终无白色沉淀生成
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42﹣
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后投入水中,两者放出的氢气质量相等
⑤将SO2通入溴水中,证明SO2具有漂白性
⑥在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后红色逐渐褪去,证明Na2CO3溶液中存在水解平衡
⑦因为SiO2能和CaCO3反应生成CO2,所以H2SiO3酸性强于H2CO3.
A. ②④⑥⑦ B. ①③④⑤ C. ③④⑤⑦ D. ②③④⑤⑦
考点: 铁盐和亚铁盐的相互转变;盐类水解的应用;二氧化硫的化学性质;硅和二氧化硅;钠的化学性质;常见阴离子的检验.
专题: 元素及其化合物.
分析: ①碳酸的酸性弱于盐酸;
②硝酸根在酸性环境下具有强的氧化性,能够氧化二价铁离子;
③检验硫酸根离子,应先加盐酸,排除其它离子的干扰;
④根据金属钠和水反应以及金属铝和氢氧化钠反应的化学方程式进行计算即可;
⑤二氧化硫通入溴水反应氧化还原反应,溴水被还原而退色;
⑥碳酸钠水解呈碱性,加入BaC12溶液,生成碳酸钡沉淀;
⑦硅酸钠溶液与二氧化碳反应生成硅酸和碳酸钠,依据常温下强酸制弱酸解答.
解答: 解:①碳酸的酸性弱于盐酸,将CO2通入BaCl2溶液中,不反应,故①正确;
②硝酸根在酸性环境下具有强的氧化性,能够氧化二价铁离子生成三价铁离子,三价铁离子遇到KSCN溶液显红色,故②正确;
③应先加盐酸,排除其它离子的干扰,所以向某溶液中滴入盐酸酸化的 BaCl2溶液产生白色沉淀,证明溶液中可能含有SO42﹣或Ag+,故③错误;
BaCl2溶液产生白色沉淀,证明溶液中可能含有SO42﹣或Ag+,故③错误;
④金属钠和水反应的原理是:2Na+2H2O=2NaOH+H2,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,先发生反应2Na+2H2O=2NaOH+H2,然后金属铝和氢氧化钠反应2Al+2NaOH+6H20=2Na+3H2,等物质的量的金属钠,在两种情况下产生氢气的量不相等,故④错误;
⑤二氧化硫通入溴水反应氧化还原反应,溴水被还原而退色,体现二氧化硫的还原性,故⑤错误;
⑥碳酸钠水解呈碱性,加入BaC12溶液,生成碳酸钡沉淀,平衡向逆方向移动,如溶液褪色,可说明Na2CO3溶液中存在水解平衡,故⑥正确;
 ⑦向一定浓度的Na2SiO3溶液中通入适量CO2气体,反应生成硅酸沉淀,酸性为碳酸大于硅酸,为强酸制取弱酸的反应,故⑦错误;
⑦向一定浓度的Na2SiO3溶液中通入适量CO2气体,反应生成硅酸沉淀,酸性为碳酸大于硅酸,为强酸制取弱酸的反应,故⑦错误;
所错误的有:③④⑤⑦;
故选:C.
点评: 本题考查了元素化合物知识,题目难度不大,熟悉物质的性质是解题关键,注意硫酸根、三价铁离子的检验,二氧化硫的性质是2015届高考的热点.


科目:高中化学 来源: 题型:
近年来发现铊(Tl)是高温超导材料的成分之一,已知铊与铝是同族元素,关于铊的下列性质判断中,可能错误的是()
A. 是银白色、质软的金属 B. 能形成+3价的化合物
C. Tl(OH)3是两性氢氧化物 D. 能与硝酸反应生成硝酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
依据元素周期表及元素周期律,下列推断正确的是()
A. P、S、Cl得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强
B. ⅠA族元素的金属性比ⅡA族元素的金属性强
C. 若M+和R2﹣的核外电子层结构相同,则原子序数R>M
D. Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:
气体A的饱和溶液 A和食盐的饱和溶液
A和食盐的饱和溶液 悬浊液
悬浊液 晶体
晶体 纯碱
纯碱
则下列叙述错误的是()
A. A气体是CO2,B气体是NH3
B. 第Ⅲ步得到的晶体是发酵粉的主要成分
C. 第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D. 第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大.
(1)已知25℃时:SO2(g)+2CO(g)═2C02(g)+ Sx(s)△H=a kJ•mol﹣1;
Sx(s)△H=a kJ•mol﹣1;
2COS(g)+SO2(g)═2CO2(g)+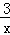 Sx(s)△H=b kJ•mol﹣1.则CO与Sx生成COS反应的热化学方程式是 .
Sx(s)△H=b kJ•mol﹣1.则CO与Sx生成COS反应的热化学方程式是 .
(2)有人设想按如图甲所示装置用废气中的SO2生产硫酸.写出SO2电极的电极反应式 .
(3)提高反应2SO2(g)+O2⇌2SO3(g)△H<0中SO2的转化率是控制SO2排放的关键措施之一.某课外活动小组进行了如下探究:
①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5min后反应达到平衡,二氧化硫的转化率为
50%,前5min内SO2的平均反应速率为 .
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是 (填序号).
a温度和容器体积不变,充入1.0molHe (g)
b温度和容器体积不变,充入2molSO2和lmolO2
c温度和容器体积不变,充入1.0molSO2
d在其他条件不变时,减小容器的容积
③在其他条件不变的情况下,探究起始时氧气物质的量对2SO2(g)+O2(g)⇌2SO3(g)反应的影响,实验结果如
图乙所示.(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的
是 ,温度T1 T2(填“>”“<”或“一”).

查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用溴和苯在FeBr3催化下制取溴苯,得到粗溴苯后,要用如下操作提纯:(1)蒸馏;(2)水洗;(3)用干燥剂干燥;(4)用10%的NaOH溶液洗涤.正确的操作顺序是()
A. (1)(2)(3)(4) B. (4)(2)(3)(1) C. (4)(1)(2)(3) D. (2)(4)(2)(3)(1)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质的说法中正确的是 ( )。
A.强电解质一定是离子化合物
B.强电解质、弱电解质的电离都是吸热过程
C.强电解质的饱和溶液一定是浓溶液
D.强电解质在水中一定能全部溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
将一块铝硅合金恰好与NaOH溶液完全反应而溶解。
(1)写出合金溶解的离子方程式。
________________________________________________________________。
(2)向所得的溶液中加入足量的盐酸,充分反应后,溶液中大量存在的离子为
________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com