
| A、工业合成氨反应使用催化剂,加快化学反应速率,并提高产率,增大经济效益 |
| B、水的离子积常数Kw只与温度有关,但加酸、碱、盐一定会影响水的电离程度 |
| C、等物质的量浓度,等体积的NaCl溶液和NaClO溶液中离子数目前者大于后者 |
| D、将等PH的盐酸溶液和醋酸溶液稀释相同的倍数,稀释后PH:盐酸<醋酸 |


科目:高中化学 来源: 题型:
| A、Al2O3(SiO2):NaOH溶液 |
| B、CO2(SO2):Na2CO3溶液 |
| C、FeCl2溶液(FeCl3):Fe粉 |
| D、NaHCO3溶液(Na2CO3溶液):Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④<②<①<③ |
| B、③<①<②<④ |
| C、④<①<②<③ |
| D、①<③<④<② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaH的水溶液显碱性 |
| B、NaH中氢离子的电子层排布与氦原子相同 |
| C、NaH中H-离子半径比H+离子半径小 |
| D、NaH中氢离子可被氧化成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称量25.20g NaCl固体 |
| B、用10mL量筒量取2.5mL稀盐酸 |
| C、用烧杯准确量出150mL 0.1mol/L的盐酸溶液 |
| D、用容量瓶配置溶液中定容时发现蒸馏水稍微过量,可用胶头滴管吸出少许 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海带提取单质碘时最后用苯进行了萃取,苯层应由分液漏斗的上口倒出 |
| B、分别给碳酸钠和碳酸氢钠两种固体加热,再用澄清石灰水可以区分这两种固体 |
| C、配制0.1000mol?L-1氢氧化钠溶液时,定容时俯视刻度线,所配溶液浓度会偏大 |
| D、次氯酸钠溶液可用于漂白和环境的消毒杀菌,通入SO2漂白及杀菌作用将增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物:铝热剂、液氨、水玻璃、明矾 |
| B、化合物:干冰、冰水混合物、烧碱、小苏打 |
| C、电解质:氯化钠、硫酸钡、氯化氢、水 |
| D、同素异形体:活性炭、C60、石墨烯、金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:
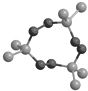 某有机物的球棍模型如图所示,该物质在撞击、摩擦时发生爆炸,被称为熵炸弹.该物质与氧气完全反应产物只有CO2和H2O.由于该上述爆炸反应不是燃烧反应,因此整个过程焓变不大.下列说法正确的是( )
某有机物的球棍模型如图所示,该物质在撞击、摩擦时发生爆炸,被称为熵炸弹.该物质与氧气完全反应产物只有CO2和H2O.由于该上述爆炸反应不是燃烧反应,因此整个过程焓变不大.下列说法正确的是( )| A、该有机物爆炸产物是CO2和H2O |
| B、该有机物的分子式为C3H6O6 |
| C、上述爆炸过程中一定放出大量的热 |
| D、上述爆炸过程中熵一定显著减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com