
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是 ( )
A. 水电离的![]() =1×10-13mol/L的溶液:K+、Na+、AlO2—、CO32—
=1×10-13mol/L的溶液:K+、Na+、AlO2—、CO32—
B. ![]() =1×10-12mol/L的溶液中:Cu2+、NH4+、Cl-、NO3-
=1×10-12mol/L的溶液中:Cu2+、NH4+、Cl-、NO3-
C. 与Al反应能放出H2的溶液:Cu2+、NO3—、K+、SO42—
D. 无色溶液中:Cr2O72—、Na+、H+、SO42—
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生如下反应:![]() ,达到平衡后测得A气体的浓度为
,达到平衡后测得A气体的浓度为![]() ,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为
,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为![]() ,则下列叙述正确的是
,则下列叙述正确的是![]()
![]()
A.平衡向正反应方向移动B.![]()
C.B的物质的量浓度减小D.C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t℃时,Y点和Z点时Ag2CrO4的Ksp相等
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t℃时,Ag2CrO4的Ksp为1×10-8
D. t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理CO2和SO2的混合气体的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是( )
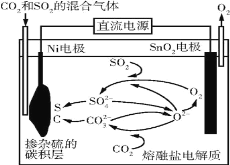
A.Ni电极表面发生了还原反应
B.阳极的电极反应为2O2--4e-=O2↑
C.电解质中发生的离子反应只有2SO2+O2+2O2-=2SO![]()
D.该过程实现了电解质中熔融碳酸盐和硫酸盐的自主补充循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向120 mL 0.005 mol·L-1 CaCl2溶液中逐滴加入0.1 mol·L-1 Na2CO3溶液,混合溶液的电导率变化曲线如图所示。已知25℃时,Ksp(CaCO3)=3.36×10-9,忽略CO32-水解。下列说法正确的是( )

A.a点对应的溶液中Ca2+开始形成沉淀,且溶液中c(Ca2+)=c(CO32-)
B.b点对应的溶液中Ca2+已完全沉淀,且存在关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.如图可以说明CaCO3在溶液中存在过饱和现象
D.在滴加Na2CO3溶液的过程中,混合溶液的pH先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,反应![]() 的平衡常数如下:
的平衡常数如下:
温度 | 207 | 387 |
平衡常数 |
|
|
下列说法正确的是( )
A.其正反应的![]()
B.207℃时,密闭容器中进行的该反应总压不变不可以作为该反应达到平衡的标志
C.387℃时,1L密闭容器中投入![]() mol的
mol的![]() ,平衡时转化率为
,平衡时转化率为![]()
D.387℃时,1L密闭容器中充入![]()
![]() mol、
mol、![]()
![]() mol和
mol和![]()
![]() mol,则反应将向正反应方向进行
mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)![]() PCl5(g) △H<0,有关数据如下:
PCl5(g) △H<0,有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/(Lmin)
B. 当容器中Cl2为1.2 mol时,反应达到平衡
C. 升高温度,反应的平衡常数增大,平衡时PCl3的物质的量浓度<1.6mol/L
D. 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molM和2 molN置于体积为2L的恒容密闭容器中,发生反应:M(s)+2N(g)![]() P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )

A. 若X、Y两点的平衡常数分别为K1、K2,则K1>K2
B. 温度为T1时,N的平衡转化率为80%,平衡常数K=40
C. 无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态
D. 降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的![]() 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应:![]() ,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法正确的是
,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法正确的是
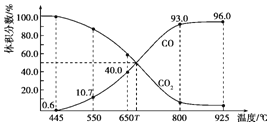
A.![]() 时,若充入惰性气体,
时,若充入惰性气体,![]() 、
、![]() 逆均减小,平衡不移动
逆均减小,平衡不移动
B.![]() 时,反应达平衡后
时,反应达平衡后![]() 的转化率为
的转化率为![]()
C.![]() 时,若充入等体积的
时,若充入等体积的![]() 和CO,平衡向逆反应方向移动
和CO,平衡向逆反应方向移动
D.平衡常数的关系:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com