


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
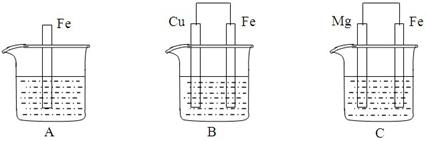
科目:高中化学 来源:不详 题型:单选题
| A.锌片是正极,铜片上有气泡产生 |
| B.电流方向是从锌片流向铜片 |
| C.溶液中的阳离子向正极移动,阴离子向负极移动 |
| D.电解液的PH值逐渐减少 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
| C.该过程中总反应为2Al + 3Ag2S =" 6Ag" + Al2S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
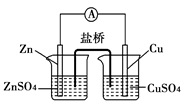
| A.电子从锌电极通过电流计流向铜电极 |
| B.盐桥中的阳离子向硫酸铜溶液中迁移 |
| C.锌电极发生氧化反应,铜电极发生还原反应 |
| D.铜电极上发生的电极反应为2H++2e-===H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化铝膜破坏后,金属铝被迅速氧化 |
| B.锌与稀硫酸反应中加入少量CuSO4溶液,反应放出H2的速率加快 |
| C.红热的铁与水接触表面上形成蓝黑色的保护层 |
| D.铁丝在氯气中燃烧产生大量棕黄色的烟 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解质溶液可能为HNO3 | B.正极材料可能为Zn |
| C.正极材料可能为Cu | D.负极上:Fe失电子被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②⑤ | B.③⑤ | C.①② | D.④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com