
【题目】下列有关NaHCO3溶液的说法正确的是
A. 该溶液中,H+、Al3+、Cl-能大量共存 B. 该溶液中c(H2CO3)<c(CO32-)
C. 该溶液中阳离子总数大于阴离子总数 D. 常温下,加水稀释,  变小
变小
【答案】C
【解析】A. HCO3-与H+反应生成二氧化碳和水而不能大量共存,HCO3-与Al3+发生双水解生成沉淀和气体而不能大量共存,选项A错误;B. NaHCO3溶液中HCO3-的水解大于电离,故c(H2CO3)>c(CO32-),选项B错误;C. 根据电荷守恒有c(Na+)+c(H+)=2(CO32-)+c(HCO3-)+c(OH-),故c(Na+)+c(H+)>(CO32-)+c(HCO3-)+c(OH-),即该溶液中阳离子总数大于阴离子总数,选项C正确;D. 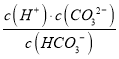 为HCO3-的电离平衡常数的表达式,温度不变,电离平衡常数不变,常温下,加水稀释,
为HCO3-的电离平衡常数的表达式,温度不变,电离平衡常数不变,常温下,加水稀释, 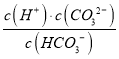 不变,选项D错误。答案选C。
不变,选项D错误。答案选C。


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,下列说法正确的是( )

A. 若实验测得m(H):m(O)>1:8,则导致这一结果的原因可能为Ⅱ装置中的CuO没有全部被还原
B. Ⅰ、Ⅱ装置之间缺少干燥装置
C. 该实验的操作顺序为:先点燃酒精灯,然后将氢气通入Ⅱ装置
D. Ⅲ装置后是否加入干燥装置,均不会对实验结果带来影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 11gC3H8与CO2的混合气体中所含碳原子数可能为0.5NA
B. 标准状况下,4.48L甲烷和乙烯的混合气体完全燃烧,产物中所含O-H键数目为0.4NA
C. 4.6gNa与100mL1mol·L-1的盐酸溶液反应,转移电子数目为0.1NA
D. 常温下,1LpH=2的硫酸溶液中由水电离出的H+的数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用。请回答下列问题:
(1)已知: H2的燃烧热为285.8kJ/mol,C2H4的燃烧热为1411.0kJ/mol,且H2O(g)=H2O(l)ΔH=-44.0kJ/mol,则CO2 和H2反应生成乙烯和水蒸气的热化学方程式为____________,上述反应在__________下自发进行(填“高温”或“低温”)。
(2)乙烯是一种重要的气体燃料,可与氧气、熔融碳酸钠组成燃料电池。写出该燃料电池负极的电极反应式:_______________________.
(3)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图所示。
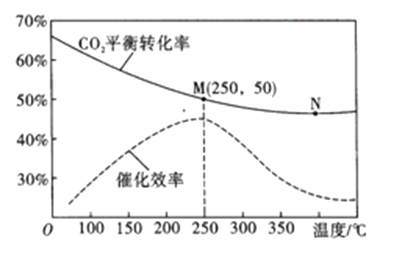
①平衡常数: KM__________KN (填“>”“<”或“=”)。
②下列说法正确的是_________(填序号)。
A.当混合气体密度不变时,说明反应达到平衡状态
B.当压强或n(H2)/n(CO2)不变时,均可证明反应已达平衡状态
C.当温度高于250℃时,因为催化剂的催化效率降低,所以平衡向逆反应方向移动
D.若将容器由“恒容”换为“恒压”,其他条件不变,则CO2的平衡转化率增大
③250℃时,将平衡后的混合气体(不考虑平衡移动) 通入300mL 3mol/L的NaOH溶液中充分反应,则所得溶液中所有离子的浓度大小关系为__________
④图中M点对应乙烯的质量分数为_____________。
(5)达平衡后,将容器体积瞬间扩大至2L并保持不变,平衡向_____移动(填“正向”“逆向”或“不”),容器内混合气体的平均相对分子质量______(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200℃和a℃时,反应X(g) ![]() 4Y(g)+Z(g)中X的浓度随时间变化的关系如图所示。
4Y(g)+Z(g)中X的浓度随时间变化的关系如图所示。
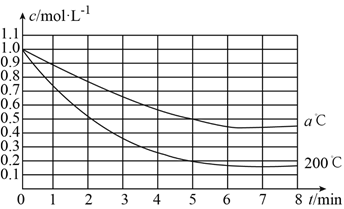
(1)200℃时5min内用Y表示的平均反应速率为__________。
(2)200℃、8min时,Z的浓度为__________。
(3)200℃时,在__________时,反应达到平衡状态。
(4)200℃、7min时,v正__________v逆(填“>”、“<”或“=”)。
(5)从图中可以看出,a__________200(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是
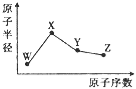
A. 简单离子半径:W>X>Z
B. 最简单气态氢化物的稳定性:Y<Z
C. 化合物XZW中既含离子键又含共价键
D. Y的氧化物能与X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是
A. 0.2mol/L的NaHCO3溶液中: c(Na+)>c(HCO3-)>c(OH-)>c(H+)
B. 叠氮酸(HN3)与醋酸酸性相近,0.1mol/LNaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+)
C. 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-)
D. 0.02mol/L的NaOH溶液与0.04mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)= c(HC2O4-)+2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)用晶体的X射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,阿伏加德罗常数为__________ (列式计算,已知Ar(Cu)=63.6);
(2)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为______。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为_______;

(3)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是___________,反应的化学方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com