
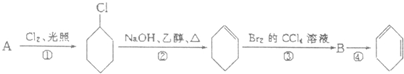
 ,生成1-氯环己烷在氢氧化钠的乙醇溶液中发生消去反应生成环己烯,环己烯与溴发生加成反应生成1,2-二溴环己烷
,生成1-氯环己烷在氢氧化钠的乙醇溶液中发生消去反应生成环己烯,环己烯与溴发生加成反应生成1,2-二溴环己烷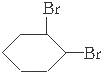 ,
, 发生消去反应可生成
发生消去反应可生成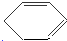 ,以此解答该题.
,以此解答该题. ,生成1-氯环己烷在氢氧化钠的乙醇溶液中发生消去反应生成环己烯,环己烯与溴发生加成反应生成1,2-二溴环己烷
,生成1-氯环己烷在氢氧化钠的乙醇溶液中发生消去反应生成环己烯,环己烯与溴发生加成反应生成1,2-二溴环己烷 ,
, 发生消去反应可生成
发生消去反应可生成 ,
, ,故答案为:
,故答案为: ;环己烷;
;环己烷;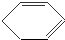 与溴的加成反应,故答案为:取代反应;加成反应;
与溴的加成反应,故答案为:取代反应;加成反应; 与溴的加成反应,反应的方程式为
与溴的加成反应,反应的方程式为 +Br2→
+Br2→ ,
, 的消去反应,反应的方程式为
的消去反应,反应的方程式为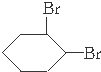 +2 NaOH
+2 NaOH| 乙醇 |
| △ |
 +2 NaBr+2 H2O,
+2 NaBr+2 H2O, +Br2→
+Br2→ ;
; +2 NaOH
+2 NaOH| 乙醇 |
| △ |
 +2 NaBr+2 H2O.
+2 NaBr+2 H2O.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
| A、在2mL10%的氢氧化钠溶液中滴入2%的硫酸铜溶液4~6滴,配制新制氢氧化铜悬浊液,检验醛基 |
| B、实验室制乙烯时,迅速升温到140℃ |
| C、用乙醇和浓硫酸除去乙酸乙酯中混有的少量乙酸 |
| D、用苯、2mol/L的硝酸和3mol/L的硫酸制硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
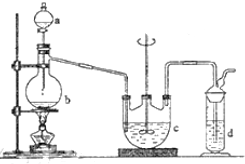 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
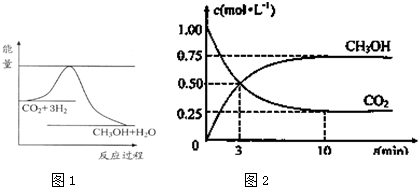
查看答案和解析>>
科目:高中化学 来源: 题型:
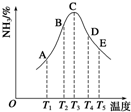 在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:
在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)?2NH3(g),并分别在t秒时测定其中NH3的体积分数,如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
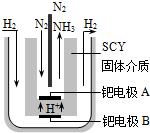 合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.
合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ba2+、Cl-、NO3- |
| B、Ba2+、Hg2+、S2-、SO42- |
| C、NH4+、H+、SO32-、PO43- |
| D、ClO-、Al3+、Br-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、③⑤ |
| C、①②③⑤ | D、①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com