
【题目】在25℃时,向20.00mL0.10mol/L一元弱碱MOH溶液中滴0.10mol/LHCl溶液,混合溶液的pH、pOH变化曲线如图所示。已知pOH=-lgc(OH-)。下列说法错误的是( )
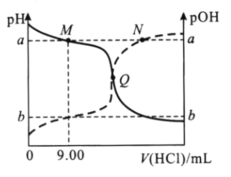
A.a+b=14
B.Q点消耗盐酸的体积小于20.00mL
C.M点和N点溶液中,![]() 相等
相等
D.当V(HCl)=10.00mL时,c(M+)-c(MOH)=c(OH-)-c(H+)
【答案】D
【解析】
A.c(H+)=10-pH=10-a时,c(OH-)=10-pOH=10-b,25℃时,c(H+)c(OH-)=10-pH×10-pOH=10-14=10-a×10-b,则a+b=14,故A正确;
B.MOH为弱碱,如果滴加盐酸20mL,恰好生成MCl,溶液显酸性,而Q点pH=pOH,此时溶液显中性,则消耗盐酸的体积小于20.00mL,故B正确;
C.![]() =
=![]() =
=![]() ,其中温度不变,Kw和Kb是定值,则M点和N点溶液中,
,其中温度不变,Kw和Kb是定值,则M点和N点溶液中,![]() 相等,故C正确;
相等,故C正确;
D.当V(HCl)=10.00mL时,溶液中溶质为MCl和MOH且等物质的量浓度,且c(MOH)<c(Cl-),已知溶液中存在的电荷守恒为c(M+)+ c(H+) =c(OH-)+c(Cl-),则c(OH-)-c(H+)= c(M+)- c(Cl-)<c(M+)-c(MOH),故D错误;
故答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氧化还原反应原理在研究物质性质及物质转化方面具有重要的的价值。
(1)化合价是学习氧化还原反应的基础。在括号中写出以下几种物质中划线元素的化合价。
NaI(____) ClO3-(____) K2MnO4 (___) Br2(___)
(2)1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将其与浓盐酸混合加热,产生黄绿色气体,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。从反应物中任选一种物质,说明其发生氧化反应(或者还原反应)的理由_______。
MnCl2+Cl2↑+2H2O。从反应物中任选一种物质,说明其发生氧化反应(或者还原反应)的理由_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫、氯及其化合物是中学化学重要的组成部分。
(1)氨气燃料电池使用的电解质溶液是KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为____;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____。
a.电能全部转化为化学能
b.SO42﹣的物质的量浓度不变(不考虑溶液体积变化)
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA个
(2)①将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:所得悬浊液![]() 白色沉淀
白色沉淀![]() 观察现象并判断,则试剂A的化学式为_____。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是____。
观察现象并判断,则试剂A的化学式为_____。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是____。
②利用如图所示电化学装置吸收工业尾气中SO2,阴极上生成Cu。写出装置中阳极的电极反应式_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. AlCl3(aq)![]() Al(OH)3(s)
Al(OH)3(s)![]() Al2O3(s)
Al2O3(s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() NaHCO3(s)
NaHCO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是日常生活中的常用调味品。回答下列问题:
(1)五种元素中,原子半径最大的是________,非金属性最强的是________(填元素符号)。
(2)由A分别和B、D、E所形成的共价型化合物中,热稳定性最差的是__________(用化学式表示)。
(3)A、B、E形成的离子化合物电子式为____________,其中存在的化学键类型为____________。
(4)D最高价氧化物的水化物的化学式为________________。
(5)单质D在充足的单质E中燃烧,反应的化学方程式为__________________;D在不充足的E中燃烧,生成的主要产物的化学式为__________。
(6)单质E与水反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,现有如下图中物质的转化关系,

试回答:(1)写出B的化学式________D的化学式_________,G俗称___________
(2)写出④的化学方程式_________________________________________
(3)写出⑥的离子方程式__________________写出⑦的离子方程式_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积不变容器中,N2(g) + 3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,下列说法不正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,下列说法不正确的是( )

A. t1时刻增大c(N2)或c(H2)B. t2时刻加入催化剂
C. t3时刻降低温度D. t4时刻往容器中充入He,以增大体系压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com