
| 反应 | 反应物 | 氧化产物和还原产物 |
| 反应① | Cl2、FeI2 | FeCl3、FeCl2、I2 |
| 反应② | MnO4-、Cl- | Cl2、Mn2+ |
| A. | 反应①中Cl2与 FeI2的物质的量之比为2:1 | |
| B. | 反应①中发生的离子方程式可能为:2Cl2+2Fe2++2I-→I2+2Fe3++4Cl- | |
| C. | 反应②中每生成1molCl2,电子转移数目为10mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+ |
分析 由于还原性:I->Fe2+>Br-,溶液中通入氯气,先发生反应:Cl2+2I-=I2 +2Cl-,再发生反应:Cl2+2Fe2+=2Fe3++2Cl-,由此分析解答.
解答 解:A、如果Cl2与 FeI2的物质的量之比为2:1,则氯气过量,则碘化亚铁完全反应,产物中无亚铁,故A错误;
B、首先氧化还原强的碘离子,所以参加反应的n(Fe2+):n(I-)≤1:2,故B错误;
C、反应②中每生成1molCl2,电子转移数目为[0-(-1)]mol×2=2mol,故C错误;
D、高锰酸根能氧化氯离子,生成氯气,而氯气能氧化亚铁离子生成铁离子,所以氧化性由强到弱顺序为MnO4->Cl2>Fe3+,故D正确;
故选D.
点评 本题考查混合物计算、氧化还原反应等,难度中等,明确离子反应先后顺序是解题关键.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
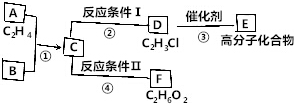 已知:
已知: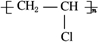 ,FCH2OHCH2OH.
,FCH2OHCH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
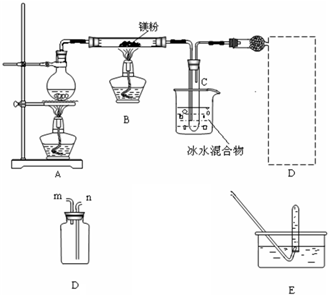
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
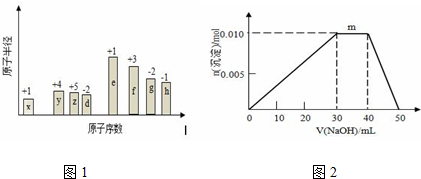
| A. | Z元素的最高价氧化物对应的水化物酸性强于Y元素的最高价氧化物对应的水化物 | |
| B. | X、Y、Z形成的简单离子的半径大小:Yn->Zm->Xm- | |
| C. | 元素Z、Y分别与元素W形成的化合物的热稳定性:WmZ<WnY | |
| D. | 若HnY溶液的酸性比HmZ溶液的酸性强,则Y的非金属性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| B | B原子最外层电子数是次外层的两倍 |
| C | C元素在空气中含量最多 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与B同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
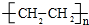 .
. ;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
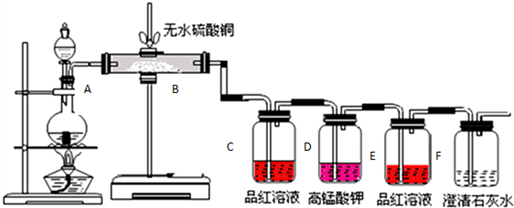
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能溶于水 | |
| B. | 能使紫色石蕊试液变红 | |
| C. | 能被弱碱氨水中和 | |
| D. | 常温下,0.1 mol•L-1醋酸溶液中的c(H+)为1.32×10-3mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com