
����Ŀ���ۺ�������[Fe2��OH��n��SO4��3��n/2]m��һ������Ч��ˮ������������ij����С��������·����Ʊ��ۺ��������������������ͼ1��
Ϊ�ⶨ��Һ������Ԫ�ص��ܺ�����ʵ��������£�ȷ��ȡ20.00mL��Һ���ڴ�����ƿ�У���������H2O2 �� ����pH��3��������У��������KI��ַ�Ӧ������0.1 000molL��1 Na2S2O3����Һ�ζ����յ㣬���ı���ҺVXmL����֪��I2+2S2O32���TI��+S4O62�� �� ��
��1��ʵ������м�����е�Ŀ���� ��
��2���ڲⶨ�����м�������H2O2������Ӧ���ӷ���ʽ�� ��
��3���ζ�������ѡ��װ����Һ��������ͼ2���Ƿ��������ǡ���
��4��д���ζ�ѡ�õ�ָʾ�� �� �ζ��յ�۲쵽������ ��
��5������ͼ1���ĵ�Na2S2O3����Һ������������Һ������Ԫ�ص��ܺ���ΪgL��1 �� ���ζ�ǰ��Һ��H2O2û�г��������ⶨ����Ԫ�صĺ����������ƫ�ߡ���ƫ�͡����䡱����
��6��������������Һ������Ԫ�ش��ڲ�ͬ�����ӣ������������������貢���ʵ�鷽��֤���������1����Һ����ֻ����Fe2+ ����2����Һ����ֻ����Fe3+ ����3�� ��
�����ṩ�Լ���ʵ����Ʒ��֤����3����
��ѡʵ���Լ���1.0molL��1 NaOH��Һ��8.0molL��1 NaOH��Һ��0.01molL��1KMnO4�����۩�KI��Һ��3moLL��1H2SO4����ɫʯ����Һ��0.1molL��1 K3[Fe��CN��6]��Һ���Թܡ���ͷ�ι�
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ������Һ�����Թ�A��B�� | |
����2�� | |
����3�� |
���𰸡�
��1����ȥ������H2O2 �� ��ֹӰ��ⶨ
��2��2H++H2O2+2Fe2+=2Fe3++2H2O
��3����
��4�����ۣ���Һ����ɫ����ɫ�ұ��ְ���Ӳ���ɫ
��5��5.6��ƫ��
��6����Һ���д���Fe2+��Fe3+
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ������Һ�����Թ�A��B�� | �� |
����2�� | ���Թ�A�е���2��3�ε��۩�KI��Һ�����۲�仯����Һ����ɫ��֤����Һ���к���Fe3+�� |
����3�� | ���Թ�B����3moL?L��1H2SO4�ữ���ٵ���2��3��KMnO4��Һ�����۲�仯�� |
���������⣺��1������˫��ˮ���������ԣ��ܹ�����Na2S2O3 �� Ӱ��ⵥ�ʵIJⶨ��˫��ˮ���ȶ������Ⱥ��ܹ���ȥ�����Լ�����е�Ŀ���dz�ȥ������H2O2 �� ��ֹӰ��ⶨ�����Դ��ǣ���ȥ������H2O2 �� ��ֹӰ��ⶨ����2��˫��ˮ���������ӷ�Ӧ�����ӷ���ʽΪ��2H++H2O2+2Fe2+=2Fe3++2H2O��
���Դ��ǣ�2H++H2O2+2Fe2+=2Fe3++2H2O�� ��3��Na2S2O3��Һ��ʾ���ԣ�Ӧ��ʹ�ü�ʽ�ζ���ʢ�ţ�ͼʾ�ζ���Ϊ��ʽ�ζ��ܣ����Բ�������
���Դ��ǣ���4�����ڵⵥ������������ʾ��ɫ���ʿ�ѡ�õ���Ϊ�ζ�ָʾ�����ζ�����ǰ��ҺΪ��ɫ���ζ�����ʱΪ��ɫ����ζ��յ������Ϊ����Һ����ɫ����ɫ�ұ��ְ���Ӳ���ɫ��
���Դ��ǣ����ۣ���Һ����ɫ����ɫ�ұ��ְ���Ӳ���ɫ���� ��5��ͼ2�г�����Ϊ0.20mL��ĩ����Ϊ20.20mL����ζ�����������Na2S2O3��Һ�����Ϊ��20.20mL��0.20mL=20.00mL��������������Ƶ����ʵ���Ϊ��0.1 000molL��1��0.02L=0.002mol��
���ݵ����غ㼰��Ӧ2H++H2O2+2Fe2+=2Fe3++2H2O��I2+2S2O32���TI��+S4O62���ɵù�ϵʽ��2Fe2+��2Fe3+��I2��2S2O32�� �� ��20.00mL��Һ���к����������ӵ����ʵ���Ϊ��n��Fe2+��=n��S2O32����=0.002mol��
������Һ������Ԫ�ص��ܺ���Ϊ�� ![]() =5.6g/L��
=5.6g/L��
���ζ�ǰ��Һ��H2O2û�г�����˫��ˮ�ܹ�������������ƣ���ⶨ�ĵⵥ�ʵ����ʵ���ƫ�����ⶨ����Ԫ�صĺ�������ƫ�ߣ�
���Դ��ǣ�5.6��ƫ�ߣ���6�����ݼ���1����Һ����ֻ����Fe2+������2����Һ����ֻ����Fe3+��֪����Һ�п���ͬʱ���������Ӻ��������ӣ��ʼ���3Ϊ����Һ���д���Fe2+��Fe3+��
��֤����3��������Ҫ�ֱ����Fe2+��Fe3+ͬʱ���ڣ�������������Ͳ���Ϊ��ȡ������Һ�����Թ�A��B�У����Թ�A�е���2��3�ε��۩�KI��Һ������Һ����ɫ��֤����Һ���к���Fe3+�����Թ�B����3moLL��1H2SO4�ữ���ٵ���2��3��KMnO4��Һ��������Һ��ɫ������ɫ��ɻ�ɫ���dz������Fe2+����������軯����Һ������ɫ�������ɣ�����Fe2+����ϲ���2��֪����3������
���Դ��ǣ���Һ���д���Fe2+��Fe3+��
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ������Һ�����Թ�A��B�� | �� |
����2�� | ���Թ�A�е���2��3�ε��۩�KI��Һ�����۲�仯����Һ����ɫ��֤����Һ���к���Fe3+�� |
����3�� | ���Թ�B����3moLL��1H2SO4�ữ���ٵ���2��3��KMnO4��Һ�����۲�仯�� |


 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д� �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D������ѧ��ѧ�г������л������������һ����������������ת����ϵ���������ʺ���������ȥ�������У�A�����ϩ��������ʽΪC2H4 �� ���������������һ������ʯ�ͻ�����չ��ˮƽ��C�������г��õ�һ�־�����ζ�ĵ�ζƷ�ijɷ֣�ͨ��״���£�D�Ǿ���Ũ����ζ����״Һ�壮 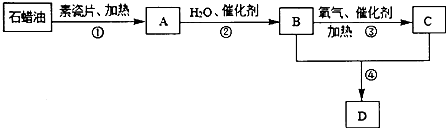
��1�����л�������A��B��C��D�У����������������ṹ��ʽ������Ӧ�ܵķ�Ӧ������ ��
��2����A��B��C��D�У��ܶȱ�ˮС��������ˮ��Һ���������������ƣ���A��һ�������¿��Է����Ӿ۷�Ӧ����һ�����ϣ������ϵĽṹ��ʽΪ ��
��3����Ӧ���У��ش�Ƭ����Ҫ������ �� һ�������£� B��C��D���������в��ܺ�NaOH��Һ��Ӧ������Ӧ���������������ƣ���
��4��ֲ��ո���һ����������ˮ��������ǣ��������ھƻ�ø����������ת��ΪB��B��ij����������·���������Ӧ�õ�C��д��������ת��ΪB�Ļ�ѧ����ʽ�� ��
��5����ʵ���һ�õ�D����������������B��C��Ϊ�ᴿD�������Ƚ��˲�����D��һ��ֻ�ϣ�Ȼ���پ��á�����������ƣ����ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�ˮֻ����������������ԭ��ӦΪ�� ( )
A.Cl2+H2O=HCl+HClOB.2F2+2H2O=4HF+O2
C.H2O+CaO=Ca(OH)2D.2Na+2H2O=2NaOH+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ۼ������ܴ�����
A.��������B.�ǽ�������C.���ӻ�����D.���ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������İ����ڸ������ܱ�����ͭ�������������ֵ��ʺ�һ�ֻ�������������Ӧ��ѡ������װ�ý��С�
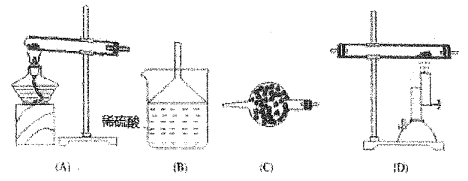
(1)�������������ʯʱ���������ӵ�˳����___________��
(2)װ��B���Լ���������_________��װ��C��������______��
(3)װ��D �з�Ӧ�Ļ�ѧ����ʽ��__________��
(4)װ��A �з�Ӧ�Ļ�ѧ����ʽ��_________ ��
(5)��ʵ����Ҫ�ռ�������ѡ��Eװ��ʱ����������Ϊ_________��ѡ��F װ��ʱ������Ӧ��______�ڽ���
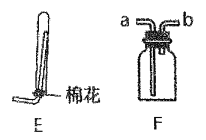
(6)��ҵ�Ʊ������Ļ�ѧ����ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Xn��������N����X��������ΪA����ag X���⻯���к����ӵ����ʵ����ǣ� ��
A. ��N��a��mol B. ![]() ��n+A��mol
��n+A��mol
C. ![]() ��N+n��mol D.
��N+n��mol D. ![]() ��A��N+n��mol
��A��N+n��mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ���������Ŀ��
��1��X��̬ԭ�ӵ�M����K���������ȣ���X���������е�һ����������Ԫ���� ��
��2����Y2+���ӵ�3d�������9�����ӣ���̬Yԭ�ӵļ۵����Ų�ʽΪ
�ڽ�Y��ĩ����NH3��Ũ��Һ�У�ͨ��O2 �� ��ַ�Ӧ����Һ������ɫ���������·�Ӧ��
2Y+8NH3H2O+O2=2[Y��NH3��4]��OH��2+6H2O���ù������γɵĻ�ѧ��������
a������ b���Ӽ� c���Լ� d�Ǽ��Լ� e��λ�� f��� g���»���
��3��K2Cr2O7��һ�ֳ�����ǿ�����������������»ᱻ��ԭ����ԭ��Cr3+ �� Cr3+����OH����CN���γ������[Cr��OH��4]����[Cr��CN��6]3�� ��
�ٲ����ǿռ乹�ͣ�[Cr��OH��4]���Ľṹ����ʾ��ͼ��ʾΪ��������λ�����ü��ű�ʾ��
��һ��������������LaCrO3�ľ�����ͼ1��ʾ����֪����ÿ��Crԭ�������Oԭ����6������ͼ��ԭ�Ӵ�������Crԭ�ӣ���A��B��C����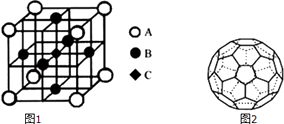
��4��̼��һ�ֵ��ʽṹ��ͼ2��ʾ������Է�������Ϊ720�����ӹ���Ϊһ��32���壬������12����Ԫ����20����Ԫ������õ�����̼ԭ�ӵ��ӻ���ʽ�� �� 1mol�õ����д��ڵĦм���ĿΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com