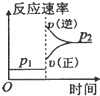
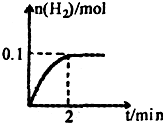(1)恒温恒容的容器内进行反应CO(g)+2H
2(g)?CH
3OH(g)
a.平衡状态各组分的含量不变,CO体积分数保持不变,证明反应达到平衡,故a正确;
b.甲醇和一氧化碳的起始量和消耗量决定,容器中甲醇浓度与CO浓度相等不能证明反应达到平衡,故B错误;
c.反应前后是气体体积减小的反应,容器中气体的压强不变,说明反应达到平衡状态,故c正确
d.化学反应速率之比等于化学方程式中计量数之比,CH
3OH的生成速率与CO的消耗速率相等,说明甲醇和一氧化碳正反应速率相同,反应正向进行不能说明反应达到平衡,故d错误;
e.容器中混合气体的密度保持不变,混合气体的密度=
,反应过程中气体质量守恒,容器体积相同,密度不变,不能证明反应达到平衡,故e错误;
故答案为:ac;
(2)CO(g)+2H
2(g)?CH
3OH(g),
a.向装置中再充入N
2,恒温恒容条件下,体系总压增大,分压不变,平衡不动,故a不符合;
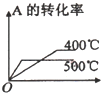
b.反应是放热反应,升高温度平衡那你想进行,转化率减小,故b不符合;
c.改变反应的催化剂,改变反应速率,不能改变化学平衡,转化率不变,故c不符合;
d.向装置中再充入H
2,提高一氧化碳转化率,故d正确;
故答案为:d;
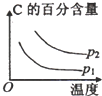
(3)图象变化分析甲烷转化率随温度升高增大,说明平衡正向进行,正反应是吸热反应,△H>0,在T℃时的1L密闭容器中,充入1mol CH
4和3mol H
2O(g),发生反应②,经过5min达到平衡,此时CH
4的转化率为50%,则
CH
4(g)+H
2O(g)?CO(g)+3H
2(g)
起始量(mol) 1 3 0 0
变化量(mol)0.5 0.5 0.5 1.5
平衡量(mol)0.5 2.5 0.5 1.5
H
2的平均反应速率=
=0.3mol/L?min;
平衡常数K=
=1.35(mol/L)
2;
故答案为:>;0.3mol/L?min,1.35;
(4)若向此1L密闭容器中,加入1mol CH
4、5mol H
2O(g)、1mol CO和3mol H
2,发生反应②,若温度仍为T℃.平衡常数K=1.35,Qc=
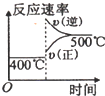
=5.4>1.35,所以反应逆向进行,v(正)<v(逆),若改变反应温度,达到新平衡时,
CH
4(g)+H
2O(g)?CO(g)+3H
2(g)
15 1 3
0 4 2 4
26 0 2
得到水蒸气的物质的量介于4-6间;
故答案为:<;4;6.

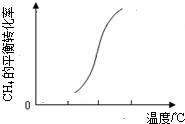 则△H2______0(填“<”、“>”或“=”).在T℃时的1L密闭容器中,充入1molCH4和3molH2O(g),发生反应②,经过5min达到平衡,此时CH4的转化率为50%,则从开始到平衡,H2的平均反应速率为______,T℃时该反应的平衡常数为______;
则△H2______0(填“<”、“>”或“=”).在T℃时的1L密闭容器中,充入1molCH4和3molH2O(g),发生反应②,经过5min达到平衡,此时CH4的转化率为50%,则从开始到平衡,H2的平均反应速率为______,T℃时该反应的平衡常数为______;