
�����й��Ȼ�ѧ����ʽ��������ȷ����
A����֪2H2��g����O2��g��= 2H2O��g������H=��483��6 kJ/mol����������ȼ����Ϊ241��8 kJ/mol
B����֪C��ʯī��s��= C�����ʯ��s������H��0������ʯ��ʯī�ȶ�
C����20��0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28��7 kJ����������÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽΪ��NaOH��aq����HCl��aq��=NaCl��aq����H2O��aq������H=��57��4 kJ/mol
D����֪2C��s����2O2��g��=2CO2��g������H1��2C��s����O2��g��=2CO��g�� ����H2�����H1<��H2

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�����ʡ�����и�����ѧ�ڵ�һ��������ѧ�Ծ��������棩 ���ͣ������
ͭ���ء��������Ԫ�صĻ�����������������̫���ܵ�ص���Ҫ���ϡ��ش��������⣺
��1����̬ͭԭ�ӵĵ����Ų�ʽΪ ����֪������CuO����Cu2O+O2���Դ�ͭԭ�Ӽ۲���ӽṹ�仯�ǶȽ�����һ��Ӧ������ԭ��________________________��
��2���������������Ԫ���γ���̬�⻯��������γɵ��������⻯���У����ӹ��ͷֱ�Ϊ ������Si-H���м��ϵ���ƫ����Ԫ�أ�����������Ӧʱ�����������������������ĵ縺����Դ�СΪ________________��
��3������Ԫ�ش���ͬһ�������Ԫ�ؾ���ȱ�����ԣ��۵��������ڼ۲����������仯���������й¶Ե��ӵķ��ӻ���������������BF3����NH3��Ӧ����BF3��NH3��BF3��NH3��Bԭ�ӵ��ӻ��������Ϊ____��B��N֮���γ� ����
��4�����ɰ(SiC)��Ӳ��Ϊ9.5���侧���ṹ��ͼ��ʾ������ɰ��������Ϊ ����SiC�У�ÿ��Cԭ����Χ�����Cԭ����ĿΪ ���������ı߳�Ϊa pm������ɰ���ܶ�Ϊ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ��������ɽ�и�����ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ˮ��D2O����Ҫ���ں˷�Ӧ�������ӵļ��ټ�����ȴ�����ڻ�ѧ������ѧ�У���ˮ������ʾ���������о���Ӧ�����ȡ�����˵����ȷ����
A��D�����һ�ֺ��أ�ԭ�Ӻ�����2������
B��1H218O��D216O����Է���������ͬ
C��3H2O��D2O����ͬλ��
D��ͨ����ѧ�仯����ֱ��ʵ����ͨˮ����ˮת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�챱���к�����������ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��(N2H2 )�ǻ�����õĸ���ȼ�ϣ�������ΪҺ�壬�����ģ������ͼ��ʾ��������˫��ˮ������Ӧ��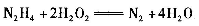 ����NA��ʾ����٤������������˵����ȷ����
����NA��ʾ����٤������������˵����ȷ����
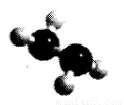
A����״���£� 11.2LN2 �к���������Ϊ5 NA
B����״���£� 22.4LN2 H4 ������ԭ������Ϊ6 NA
C����״���£� 3.2gN 2H4 �к��й��ۼ�������Ϊ0.6 NA
D��������3.6gH2 O����������Ӧת�Ƶ��ӵ���ĿΪ0.2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ������ѧ�ڰ��ڿ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ڷ�ӦKCl03+ HCl --- KC1 + Cl2 ��+ H20��δ��ƽ������0��1 mol KCl03 �μӷ�Ӧ������˵����ȷ����
A��ת��0��5 mol����
B������0��1 mol Cl2
C����������HC1Ϊ0��6 mol
D��Cl2��ֻ���������ﲻ�ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���Ĵ�ʡ��������ͨ���и���10������Բ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��TiO2ת��ΪTiCl4�ǹ�ҵұ�������ѵ���Ҫ��Ӧ֮һ����֪��
TiO2(s)��2Cl2(g)=TiCl4(l)��O2(g) ��H ����140.5kJ?mol��1
C(s��ʯī)�� 1/2 O2(g)=CO(g) ��H ����110.5kJ?mol-1
��ӦTiO2(s)��2Cl2(g)��2C(s��ʯī)=TiCl4(l)��2CO(g)�Ħ�H��
A����80.5kJ?mol��1
B����30.0kJ?mol��1
C����30.0kJ?mol��1
D����80.5kJ?mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������������������ѧ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з��������ӻ���Ӱٷ�������
������ijһ��ֵ�Ũ�� ��������ϵ��ѹǿ ��������ϵ���¶� ��ʹ�ú��ʵĴ���
A�� �٢� B�� �ڢ� C�� �ۢ� D�� �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ�ʡ��һ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��ȷ
A����������Һ��ͭ��Cu+Ag+=Cu2++Ag
B������ͭ�����ᷴӦ��O2��+2H+=H2O
C��̼�ᱵ�����CO32��+2H+=H2O+CO2��
D��Cu(OH)2����H2SO4��2H++Cu(OH)2 = Cu2+ +2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����������и�һ��ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ������д������
A���ù��Ϊ10.0mL����Ͳ��ȡ6.0mL��Һ��
B����ҩ����ֽ�۰ѷ�ĩ״ҩƷ�����Թܵĵײ�
C������ʱ��������ĩ��Ӧ������������ֽ��
D�����û���ԹܼУ�������ʱ�ֳ��Թܸ������Һ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com