
【题目】![]() 的物质的量浓度相等的下列溶液:①(NH4)2SO4 ② (NH4)2Fe(SO4)2 ③(NH4)2CO3,溶质的物质的量浓度由大到小的顺序为
的物质的量浓度相等的下列溶液:①(NH4)2SO4 ② (NH4)2Fe(SO4)2 ③(NH4)2CO3,溶质的物质的量浓度由大到小的顺序为
A. ① > ② > ③ B. ③ > ① > ②
C. ③ > ② > ① D. ② > ① > ③
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g)![]() 2SO3(g),平衡混合体系中SO3的百分含量和温度的关如图所示,根据如图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关如图所示,根据如图回答下列问题:

①2SO2(g)+O2(g)![]() 2SO3(g)为__________反应(填“吸热”“放热”)。
2SO3(g)为__________反应(填“吸热”“放热”)。
②一定条件下,将SO2与O2以体积比为2︰1置于一体积不变的密闭容器中发生反应,能说明该反应已达到平衡的是________(填选项字母)。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量分数不再变化
d.单位时间内转移4 mol电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
③V2O5可作为2SO2(g)+O2(g)![]() 2SO3(g)的催化剂,催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化为V2O5。写也该催化循环机理的化学方程式__________,________。
2SO3(g)的催化剂,催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化为V2O5。写也该催化循环机理的化学方程式__________,________。
(2)一定条件下,合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0。图1表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图2表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)ΔH<0。图1表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图2表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
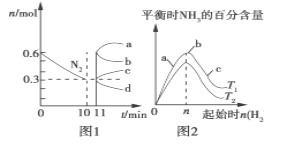
①由图1信息,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填“a”“b”“c”或“d”,下同);增加氮气的物质的量,则n(N2)的变化曲线为________。
②由图2信息,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是________点,T2____T1(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种元素,它们的相关信息如下表:
元素代号 | 相关信息 |
A | 最外层的电子数是次外层电子数的3倍 |
B | 海水中含量第一位的金属元素 |
C | L层得1个电子后成为稳定结构 |
D | 二价阴离子核外有18个电子 |
E | 失去一个电子后就成为一个原子 |
F | 单质为大气中含量最多的气体 |
请填写下列空格:
(1)A原子的电子式:_______________________________。
(2)B离子的结构示意图:__________________________,与B离子质子数与电子数均相同的微粒可能是____________________________________(写出两种,用微粒符合表示)。
(3)C元素的名称:________,C原子中能量最高的电子位于第________层。
(4)D的二价阴离子的电子式:___________________________;D元素的某种同位素原子质量数为34,该原子核内的中子数为______________。
(5)A、E、F三种元素能相互形成多种类别的物质,其中属于共价化合物为________,离子化合物为________(各写出一种物质即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的一组是
A. H和D互为同位素 B. 丁烯和环丁烷互为同分异构体
C. 碳链![]() 与
与 ![]() 的烃为同系物 D. 金刚石、石墨和C60为同素异形体
的烃为同系物 D. 金刚石、石墨和C60为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.72g金属钠、氧化钠和过氧化钠的混合物与足量水反应,在标准状况下得到672mL混合气体,将混合气体电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为( )
A. 3:2:1 B. 4:2:1 C. 2:1:1 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2S是一种二元弱酸,回答以下问题:
(1)0.1mol/L NaHS溶液显碱性,则c(S2-)___________c(H2S)(填“大于” ,“小于” 或“等于” ) 。
(2)常温下,向0.2 mol/L的H2S溶液中逐滴滴入0.2 mol/L NaOH溶液至中性,此时溶液中以下所示关系一定正确的是________。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)=c(HS-)+2c(S2-)
C.c(Na+) > c(HS-)+c(S2-)+c(H2S)
D.c(H2S) > c(S2-)
(3)已知常温下,CaS饱和溶液中存在平衡:CaS(s)![]() Ca2+(aq)+S2-(aq) ΔH>0。
Ca2+(aq)+S2-(aq) ΔH>0。
①温度升高时,Ksp________ (填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是______________________________________________(用文字和离子方程式说明)。
(4)若向CaS悬浊液中加入Cu(NO3)2溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第20届中国国际工业博览会上,华东师范大学带来一种“锌+碘”新型安全动力电池,亮相工博会高校展区。“锌+碘”新型安全动力电池有望取代目前广泛使用的“铅蓄电池”、“锂电池”等,已知该电池的工作原理如图所示。下列有关说法错误的是

A. 该电池安全性高,且对环境友好
B. 正极反应式为I3-+2e-=3I-,电极a附近显红色
C. 电子的移动方向为“Zn→电极a→电极b→石墨毡”
D. “回流通道”可以减缓电池两室的压差,避免电池受损
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:A+B![]() C ,下列条件的改变一定能使化学反应速率加快的是
C ,下列条件的改变一定能使化学反应速率加快的是
A. 增加A的物质的量 B. 减少C的物质的量浓度
C. 增加体系的压强 D. 升高体系的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com