
【题目】实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中所含杂质与酸不反应,请根据实验回答:

(1)将准确称取的5g烧碱样品配成100 mL待测液,需要的主要仪器除量筒、烧杯、
玻璃棒、托盘天平外,还必须用到的仪器有:____________、_____________。
(2)取10.00 mL待测液,选择右图中_________(填A或B)来移取。
(3)用0.5000mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂。滴定时左手
旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________________,
直到滴定终点。滴定达到终点的标志是:_______________________________。
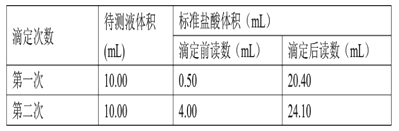
(4)根据下列数据,烧碱的纯度为:_______________________
(5)判断下列操作引起的误差(填偏大、偏小或无影响)
①滴定前读数正确,滴定终点读数时仰视_________________
②装待测液前,锥形瓶内残留少量蒸馏水_______________
【答案】100mL容量瓶胶头滴管A锥形瓶内溶液颜色变化溶液由红色变为无色且半分钟不恢复原色80.0%偏大无影响
【解析】分析:(1)用称量好的烧碱样品配成100mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有100mL容量瓶、胶头滴管。
(2)碱性溶液用碱式滴定管量取;(3)滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地向同一方向摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴入一滴溶液,锥形瓶内溶液颜色由黄色变成橙色,且30s内不变色为止,可判断滴定到达终点。
(4)两次滴定消耗盐酸的体积是19.90ml和20.10ml,所以消耗盐酸的体积平均值是20.00ml。
(5)①读数:滴定前平视,滴定后仰,则读数偏大,消耗盐酸的体积偏大,测定结果偏大。
②锥形瓶内残留少量蒸馏水,对氢氧化钠的物质的量没影响,对实验没有影响
(1)准确配制成100 mL待测液,要在容量瓶中进行,定容时需要胶头滴管,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的仪器有:100ml容量瓶 、胶头滴管。(2)待测液呈碱性,取10.00 mL待测液,选择碱式滴定管来移取,故选A;(3)为准确控制滴定终点,滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色变化;随盐酸的滴入,PH逐渐增大,溶液颜色变浅,滴定达到终点的标志是:溶液由红色变为无色且半分钟不恢复原色;(4)两次操作平均消耗盐酸20.00mL,烧碱溶液的浓度是![]() =1mol/L;烧碱的纯度为1mol/L×0.1L×40g/mol÷5g×100%= 80.0%;
=1mol/L;烧碱的纯度为1mol/L×0.1L×40g/mol÷5g×100%= 80.0%;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
I.已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) △H=+148OkJ/mol
(1)请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式_______。
Ⅱ.生成的FeO和Fe2O3在一定条件下被还原为金属铁。
(2)据报道一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
① 原子序数为26的铁元素位于元素周期表的第_______周期。
②反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量消耗4.8g。则该段时间内用H2表达的平均反应速率为____________。
③将一定量的Fe2O3(s)和一定量的CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是___________。
a.CH4的转化率等于CO的产率 b.混合气体的平均相对分子质量不变
c.v正(CO):v逆(H2)=1:2 d.固体的总质量不变
(3)FeO可用CO进行还原,已知:t℃时,FeO(s)+CO(g)![]() Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Ⅲ. Fe2O3还可用来制备FeCl3,FeCl3在水溶液中的水解分三步:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O![]() Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
(4)以上水解反应的平衡常效K1、K2、K3由大到小的顺序是_______。通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O===Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是__________(填字母)
a.加水稀释 b.加入少量NaCl固体 c.升温 d.加入少量Na2CO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )

A. 消耗22.4 LCO2可制得1mol乙酸
B. 该反应过程符合“绿色化学”原理,其原子利用率为100%
C. 该反应属于取代反应
D. 反应物和生成物中均含有极性键和非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ·mol—1)的变化。
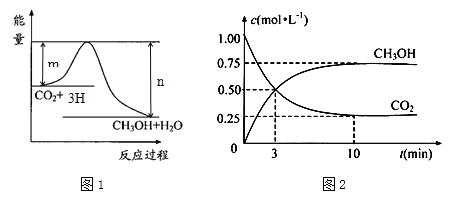
(1)写出该反应的热化学方程式__________________________。
(2)关于该反应的下列说法中,正确的是___________。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为:________________。
(4)温度降低,平衡常数K____________(填“增大”、 “不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=______________________。
(6)下列措施中能使n(CH3OH)/n(CO2)增大的有____________。
A.升高温度 B.加入催化剂
C.将H2O(g)从体系中分离 D.充入He(g),使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与范德华力无关的是( )
A. 气体物质加压或降温时能凝结或凝固
B. 通常状况下氯化氢为气体
C. 氟、氯、溴、碘单质的熔、沸点依次升高
D. 氟、氯、溴、碘的气态氢化物的稳定性越来越弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆
B.NH4HCO3受热易分解,可用作氮肥
C.明矾溶于水产生的硫酸根离子有氧化性,可用于净水
D.常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,一定能大量共存的离子组是
A.K+、Ba2+、SO42-、HCO3- B.Al3+、Fe2+、Cl-、MnO4-
C.Na+、NH4+、NO3-、Cl- D.K+、Mg2+、NO3-、OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com