

| 1 |
| 2 |
 ,利用均摊法计算.
,利用均摊法计算.| 1 |
| 2 |
| 5+1×3 |
| 2 |
| 3+1×3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |
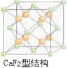
 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,故答案为:Cu3AuH8.
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,故答案为:Cu3AuH8.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、 实验室制取氨气 |
B、 配制100mL 0.1mol/L盐酸 |
C、 测定中和反应的反应热 |
D、 实验室制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 高温 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g)△H1 ②H2(g)+CO2(g)?H2O(g)+CO(g)△H2 ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H3 |
K1K2 K3 | 2.51.0 | 0.341.70 | 0.152.52 |
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家认为,氢气是一种高效而无污染的理想能源.为减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.
科学家认为,氢气是一种高效而无污染的理想能源.为减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠与水反应:2O22-+2H2O═O2↑+4OH- |
| B、次氯酸钠与Fe(OH)3在碱性溶液中反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
| C、向明矾[KAl(SO4)2?12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| D、向碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 内容 | 评价 |
| A | 一定条件下0.5mol N2和1.5mol H2反应,平衡时放热a kJ,则N2(g)+3H2(g)?2NH3(g)△H=2a kJ?mol-1 | 正确 |
| B | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | 错误,氨水不应写成离 子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-═BaSO4↓ |
正确 |
| D | 等物质的量的Cl2与FeBr2在溶液中反应: 2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
错误,Fe2+与Br-的化学计量数之比应为l:2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、未加入稀氢氧化钠之前c(CH3COO-)<c(CH3COOH) |
| B、加稀氢氧化钠后溶液中[c(CH3COO-)?c(H+)]/c(CH3COOH)变大 |
| C、加稀氢氧化钠后CH3COOH的电离程度减小,但c( OH-)增大 |
| D、pH=7时,溶液中c( Na+)=c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com