
【题目】下图表示几种无机物之间的转换关系。其中A为磁性黑色晶体,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体。
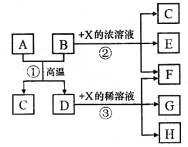
请回答下列问题:
(1)A的化学式为____________,C的电子式为_______________。
(2)反应②的化学方程式为___________________________。
(3)A与盐酸反应的离子方程式为________________________。
(4)反应③在X溶液温度、浓度不同时,产物也不同,则过量的D分别与一定量不同温度、浓度的X稀溶液反应时,若4mol X参加反应转移了3mol电子,此时反应的离子方程式为____________________;若5mol X参加反应转移了4mol电子,此时X的还原产物可能是下列选项中的______________。
a.NO b.N2O c.N2 d.NH4NO3
【答案】(1)Fe3O4,![]() ;
;
(2)C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(3)Fe3O4+8H+=2Fe3++Fe2++4H2O;
(4)3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,bd。
【解析】
试题分析:A为磁性黑色晶体,说明A为Fe3O4,D为金属,反应①是置换反应,B为非金属单质,则B为C,C为无毒气体,则C为CO2,D为Fe,E为红棕色气体,E为NO2,即X为硝酸,F为H2O,(1)根据上述分子,A为Fe3O4,C为CO2,其电子式为![]() ;(2)反应的化学反应方程式为C+4HNO3(浓)
;(2)反应的化学反应方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O ;(3)四氧化三铁可以看作由+2价、+3价铁组成,和盐酸反应的离子方程式为:Fe3O4+8H+=2 Fe3++Fe2++4H2O;(4)铁是过量,因此和硝酸反应后铁以Fe2+存在,消耗铁的物质的量为3/2mol=1.5mol,参加反应铁的物质的量和硝酸的物质的量之比为1.5:4=3:8,离子反应方程式为:3Fe+8H++2NO3-=3 Fe2++2NO↑+4H2O,;消耗铁的物质的量与消耗盐酸的物质的量之比为1.5:5=3:10,如果表现酸性的硝酸,只以Fe(NO3)2存在,作氧化剂的硝酸的物质的量为4mol,设还原产物中N的化合价为x,即4×(5-x)=4,即x=1,还原产物为N2O,硝酸表现酸性,除以Fe(NO3)2形式存在外,还以NH4NO3形式存在,也符合题意,故选项bd正确。
CO2↑+4NO2↑+2H2O ;(3)四氧化三铁可以看作由+2价、+3价铁组成,和盐酸反应的离子方程式为:Fe3O4+8H+=2 Fe3++Fe2++4H2O;(4)铁是过量,因此和硝酸反应后铁以Fe2+存在,消耗铁的物质的量为3/2mol=1.5mol,参加反应铁的物质的量和硝酸的物质的量之比为1.5:4=3:8,离子反应方程式为:3Fe+8H++2NO3-=3 Fe2++2NO↑+4H2O,;消耗铁的物质的量与消耗盐酸的物质的量之比为1.5:5=3:10,如果表现酸性的硝酸,只以Fe(NO3)2存在,作氧化剂的硝酸的物质的量为4mol,设还原产物中N的化合价为x,即4×(5-x)=4,即x=1,还原产物为N2O,硝酸表现酸性,除以Fe(NO3)2形式存在外,还以NH4NO3形式存在,也符合题意,故选项bd正确。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行如下反应:2SO2(气)+O2(气)![]() 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
A.SO2为0.4mol/L、O2为0.2mol/L B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L D.SO3为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示。
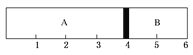
(1)A室混合气体的物质的量为________,所含分子总数为________。
(2)实验测得A室混合气体的质量为34 g,则该混合气体的密度是同温同压条件下氦气密度的________倍。
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在________刻度,容器内气体压强与反应前气体压强之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原电池的说法中正确的是( )
A.电极一定要由两种不同的金属组成
B.电子流出的一极是正极
C.两极均发生氧化还原反应
D.由化学能转化为电能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O,其中Pb(BF4)2为可溶于水的强电解质,用该铅蓄电池分别电解AgNO3溶液和Na2SO3溶液,装置如下图,a、b、c、d电极材料均为石墨,通电时a电极质量增加。
2Pb(BF4)2+2H2O,其中Pb(BF4)2为可溶于水的强电解质,用该铅蓄电池分别电解AgNO3溶液和Na2SO3溶液,装置如下图,a、b、c、d电极材料均为石墨,通电时a电极质量增加。
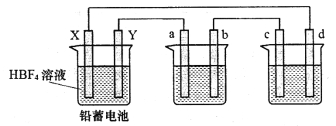
回答下列问题:
(1)d电极为该装置的___________极,工作时,该池内d电极上无气体产生,写出该池内电解反应的离子方程式:_____________________。
(2)该铅蓄电池放电时X极附近pH_____________ (填“增大”、“减小”或“不变”),正极的电极反应式为______________________。
(3)铅蓄电池充电时,Y电极与电源的_________(填“正极”或“负极”)相连。
(4)另取一常规铅蓄电池(浓硫酸作电解质溶液)与该铅蓄电池同时放电,当电路中均通过1 mol电子时,分别取下Y电极称重,两电极质量相差__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s[K] | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
下列说法中错误的是
A.500 s时O2的浓度为0.075 mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列与化学有关的说法正确的是
A. 胺态氮肥和草木灰混合使用可增加肥效
B. 氢氟酸刻蚀水晶饰品体现其酸性
C. 电渗析法、蒸馏法、离子交换法是海水淡化的常用方法
D. 煤经过气化和液化等物理变化可转为清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中处处有化学,化学是人类进步的关键。下列表述错误的是
A. 汽车排放的尾气和冬季取暖排放的颗粒污染物是形成雾霾的一个因素
B. 泡沫灭火器中用的是小苏打和硫酸铝
C. 用活性炭为糖浆脱色和用臭氧漂白纸浆,二者所用原理相同
D. 从海水中可提取镁,电解熔融氯化镁可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制下列溶液时常需加入少量括号内的物质,其中不是为了抑制离子水解的是
A.FeSO4(Fe) B.SnCl2(HCl) C.FeCl3(HCl) D.NaAlO2(NaOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com