
下列有关实验装置进行的相应实验,不能达到实验目的的是
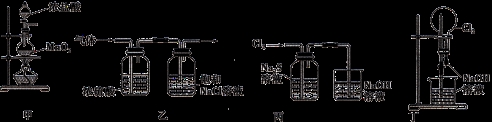
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢和水蒸气
C.用装置丙可证明Cl2的氧化性强于S
D.用装置丁可以完成“喷泉”实验
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2016-2017学年广西桂林市高三上学期期中考化学试卷(解析版) 题型:选择题
通式为CnH2n-2的一种气态烃完全燃烧后生成的CO2和H2O物质的量之比为4∶3。这种烃的链状同分异构体有 ( )
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上阶段考二化学卷(解析版) 题型:填空题
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
I.已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。
⑴NaHA溶液__________(选填“显酸性”、“显碱性”、“显中性”或“无法确定”)。
⑵某温度下,0.1 mol/L的NaHA溶液,下列关系中,一定正确的是___________。
A.c(H+)·c(OH-)=1×10―14
B.c(Na+)+c(H+)=c(HA-)+2c(A2-)
C.c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.c(Na+)=c(HA-)+c(A2-)+c(H2A)
⑶已知常温下,H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。
①降低温度时,Ksp_______(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)__________。
③测得25℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol/L,则溶液中c(A2-)= _________mol/L
II.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温 下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上阶段考二化学卷(解析版) 题型:选择题
在由水电离产生的H+浓度为1×10-13mol ·L-1的溶液中,一定能大量共存的离子组是( )
·L-1的溶液中,一定能大量共存的离子组是( )
① K+、Cl-、NO3-、S2-
② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
查看答案和解析>>
科目:高中化学 来源:2017届宁夏银川市高三上学期第三次月考化学试卷(解析版) 题型:填空题
Na、Al、Fe是生活中常见的金属元素。
(1)工业上以铝土矿(主要成分Al2O3·3H2O)为原料生产铝,主要包括下列过程:
①将粉碎、筛选后的铝土矿溶解在氢氧化钠溶液中;
②通入过量二氧化碳使①所得溶液中析出氢氧化铝固体;③使氢氧化铝脱水生成氧化铝;④电解熔融氧化铝生成铝。
写出②所涉及离子反应方程式: ,蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与Al2O3·6H2O混合并加热,可得到无水AlCl3,用化学方程式解释: 。
(2)铁在地壳中的含量约占5%左右。铁矿石的种类很多,重要的有磁铁矿石、赤铁矿石等。红热的铁能跟水蒸气反应,则其反应的化学方程式为 。生成的黑色物质溶于酸后,加入KSCN溶液,见不到血红色产生,其原因是 、 (用离子方程式解释)。工业炼铁常用赤铁矿与Al在高温下反应制备,写出该反应的方程式: 。
(3)钠的化合物中,其中纯碱显碱性的原因是 (用离子方程式解释),向饱和的纯碱溶液中通入过量的二氧化碳所产生现象 ,该物质是 。(写化学式)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期期中质量检测化学试卷(解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.澄清透明的溶液中:K+、Al3+、SO42-、MnO4-
B.1.0 mol•L-1FeCl3溶液中:Na+、Cl-、NO3-、SCN-
C.1.0 mol•L-1KNO3溶液中:Fe2+、H+、Cl-、SO42-
D.中性溶液中:Fe3+、Na+、Br?、SO42-
查看答案和解析>>
科目:高中化学 来源:2017届吉林省吉林市高三毕业班第一次调研测化学试卷(解析版) 题型:选择题
下列物质中,常做还原剂的是
A.硝酸 B.Na2SO4 C.CO2 D.FeCl2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一上月考三化学卷(解析版) 题型:推断题
如图中A到F是化合物,且A、B、E、F均含钠元素,G是单质。

(1)写出A、B、E、F的化学式:A ,B ,E ,F 。
(2)写出反应①②③的化学方程式:
①
②
③
(3)写出D和E生成F和G的化学方程式,并用双线桥表示出电子转移
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:填空题
利用I2O5可消除CO污染或定量测定CO,反应为:
5CO(g)+I2O5(s)5CO2(g)+I2(s);ΔH1
(1)已知:2CO(g)+O2(g)2CO2(g);ΔH2
2I2(s)+5O2(g)2 I2O5(s);ΔH3
I2O5(s);ΔH3
则ΔH 1= (用含ΔH 2和ΔH 3的代数式表示)。
(2)不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。请回答:
①c点正反应速率 逆反应速率(填“大于”、“等于”或“小于”), a点逆反应速率 d点逆反应速率(填“大于”、“等于”或“小于”)
②下列说法正确的是 。(填字母 序号)(双选)
序号)(双选)
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的平均相对分子质量相等
C.增加I2O5的投料量有利于提高CO的转化率
D.b点和d点的化学平衡常数:Kb<Kd
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com