
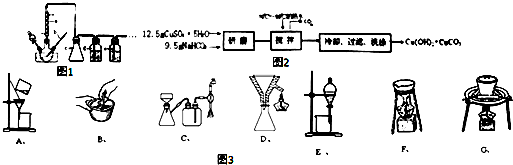
分析 (1)根据图1可以看出b仪器为温度计,c为安全瓶;
(2)制备CO时,先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸;
(3)碱式碳酸铜不稳定,温度过高容易分解;
(4)碱式碳酸铜滴入甲酸生成四水合甲酸铜和二氧化碳,据此书写方程式;
(5)①根据倾析法的操作方法选用仪器;
③根据步骤(Ⅱ)中制备甲酸铜的操作步骤选用需要的仪器;
(6)根据n=$\frac{m}{M}$计算出硫酸铜晶体、碳酸氢钠的物质的量,然后根据不足量计算出生成碱式碳酸铜的物质的量,再根据反应Cu(OH)2•CuCO3+4HCOOH+5H2O═Cu(HCOO)2•4H2O+CO2↑计算出理论上生成甲酸铜晶体的质量,最后计算出产率.
解答 解:(1)根据图1可以看出b仪器为温度计;因为HCOOH易溶于水,会发生倒吸现象,需在收集前加一个安全瓶,所以c为安全瓶作用防倒吸,
故答案为:温度计;防倒吸;
(2)制备CO时,先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸;故答案为:先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸;
(3)用于碱式碳酸铜不稳定,温度过高导致Cu(OH)2?CuCO3分解生成黑色的氧化铜、二氧化碳气体和水,影响其产率,
故答案为:温度过高导致Cu(OH)2?CuCO3分解;
(4)碱式碳酸铜滴入甲酸生成四水合甲酸铜和二氧化碳,则方程式为Cu(OH)2•CuCO3+4HCOOH+5H2O═Cu(HCOO)2•4H2O+CO2↑;故答案为:Cu(OH)2•CuCO3+4HCOOH+5H2O═Cu(HCOO)2•4H2O+CO2↑;
(5)①倾析法分离溶液时,选用使用到烧杯和用于引流的仪器玻璃棒,
故答案为:烧杯、玻璃棒;
③根据甲酸铜的制备步骤可知,需要减压过滤、趁热过滤和蒸发装置,所以需要的装置有C、D、F,
故答案为:CDF;
(6)12.5g硫酸铜晶体的物质的量为:$\frac{12.5g}{250g/mol}$=0.05mol,
9.5g碳酸氢钠的物质的量为:$\frac{9.5g}{84g/mol}$≈0.113mol,
根据反应2CuSO4+4NaHCO3═Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O可知,碳酸氢钠过量,反应生成的碱式碳酸铜的物质的量为0.05mol,
根据反应Cu(OH)2•CuCO3+4HCOOH+5H2O═Cu(HCOO)2•4H2O+CO2↑可知,生成甲酸铜的物质的量为0.05mol,
所以甲酸铜的产率为:$\frac{7.91g}{226g/mol×0.05mol}$×100%=70%,
故答案为:70%.
点评 本题通过用甲酸制备一氧化碳、甲酸铜晶体的制备,考查物质性质实验方案的设计方法,题目难度中等,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验、化学计算能力,是一道质量较好的试题.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | N≡N | F-F | N-F |
| 键能:kJ/mol | 941.7 | 154.8 | 283.0 |
| A. | 过程F2(g)→2F(g)吸收能量 | |
| B. | 过程N(g)+3F(g)→NF3(g) 放出能量 | |
| C. | 反应N2(g)+3F2(g)=2NF3(g) 放出能量 | |
| D. | NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 亚硝酸钠可大量用于染料和有机合成工业.
亚硝酸钠可大量用于染料和有机合成工业.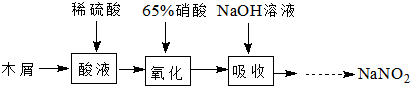
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
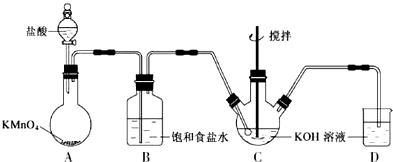
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
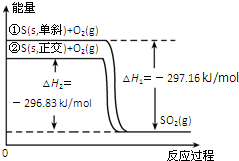
| A. | 单斜硫转化为正交硫的反应是吸热反应 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | ①表示断裂1mol O2中的共价键所吸收的能量比形成lmolSO2中的共价键所放出的能量少297.16 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com