
分析 (1)反应热=反应物键能之和-生成物中键能之和,利用化学计量数关系分析熵变;
(2)中和热是强酸强碱发生反应生成1mol水放出的热量,据此书写热化学方程式,1mol的稀硫酸含有2molH+,全部反应生成2mol水;
(3)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池中,相对于电解质溶液来讲,铝更活泼,原电池的总反应一般是负极和电解质溶液的反应,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,负极为锌失电子发生氧化反应,电极反应Zn-2e-+2OH-=Zn(OH)2;依据产物和电子守恒写出正极反应:FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ;有正极反应和负极反应合并得到电池反应.
解答 解:(1)N≡N的键能是946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为390.8kJ/mol,则
N2(g)+3H2(g)?2NH3(g)△H=946kJ/mol+3×436kJ/mol-6×390.8kJ/mol=-90.8kJ/mol,
该热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-90.8 kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-90.8kJ/mol
(2)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,1mol的稀硫酸含有2molH+,全部反应生成2mol水,生成1mol水放热$\frac{a}{2}$KJ,中和热的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-$\frac{a}{2}$kJ/mol;
故答案为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-$\frac{a}{2}$kJ/mol;
(3)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池中,相对于电解质溶液NaOH溶液来讲,铝更活泼,故铝做负极,原电池的总反应一般是负极和电解质溶液的反应,故反应方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑,负极电极反应为:Al-3e+4OH-=2H2O+AlO2-,原电池的负极发生氧化反应,正极电极反应式为:①FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-;负极电极反应为:②Zn-2e-+2OH-=Zn(OH)2;依据电极反应的电子守恒,①×2+②×3合并得到电池反应为:3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-,
故答案为:负;Al-3e+4OH-=2H2O+AlO2-;FeO42-+3e-+4H2O=Fe(OH)3+5OH-;3Zn+2FeO42-+8H2O=2Fe(OH)3+4OH-+3Zn(OH)2.
点评 本题考查了氧化还原反应、原电池的工作原理的应用、电极反应式的书写等,题目难度中等,熟悉氧化还原反应的规律、原电池的工作原理是解题关键,注意培养阅读材料获取信息的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、NH4+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | K+、Na+、SO42-、Cl- | D. | Ba2+、CO32-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离水和乙醇的混合物 | |
| B. | 可用湿润的淀粉碘化钾试纸检验氯气 | |
| C. | 用氢氧化钠溶液除去二氧化碳气体中的氯化氢 | |
| D. | 某溶液焰色反应的火焰呈黄色,说明该溶液中只含有钠离子不含钾离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物CH3CH(CH2CH3)2名称3-甲基戊烷 | |
| B. | 用新制的Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| C. | 有机物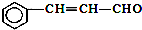 可发生加成反应、氧化反应、还原反应和聚合反应 可发生加成反应、氧化反应、还原反应和聚合反应 | |
| D. | 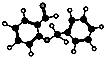 图所示的有机物分子式为C14H12O2,不能发生银镜反应 图所示的有机物分子式为C14H12O2,不能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
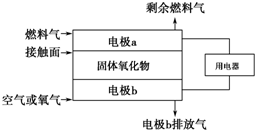 以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染的特点,其工作原理如图所示.下列说法正确的是( )
以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染的特点,其工作原理如图所示.下列说法正确的是( )| A. | 该电池工作时的总反应式为4NH3+5O2═4NO+6H2O | |
| B. | 电池工作时,接触面上的电极反应式为2NH3+3O2--6e-═N2+3H2O | |
| C. | 固体氧化物作为电池工作时的电解质,其作用是让电子在电池内部移动 | |
| D. | 外电路的电流方向为从电极a流向电极b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 moL/L NaOH溶液充分混合,若混合后溶液的体积为10mL,則混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-4mol/L,若a>7,則pH-定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和稀硝酸反应 Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O | |
| B. | 锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag | |
| C. | 氯气和氢氧化钙溶液反应 Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 盐酸和氨水反应 H++OH-=H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com