
(6分)(2012?重庆)萤火虫发光原理如图:

关于荧光素及氧化荧光素的叙述,正确的是( )
A.互为同系物 B.均可发生硝化反应
C.均可与碳酸氢钠反应 D.均最多有7个碳原子共平面
科目:高中化学 来源:2013-2014上海市静安区第二学期高二学业水平测试化学试卷(解析版) 题型:选择题
能用离子方程式Ba2++SO42- →BaSO4↓表示的是
A.氯化钡和硫酸钠溶液反应 B. 碳酸钡和稀硫酸反应
C.氢氧化钡和硫酸铝溶液反应 D. 氢氧化钡和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源:2013-20147山东省乳山市下学期期中考试高二化学试卷(解析版) 题型:简答题
(11分)某芳香族化合物H常用作防腐剂,H可利用下列路线合成:
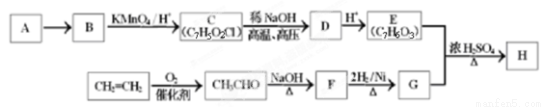
已知:①A是相对分子质量为92的烃;

④ D的核磁共振氢谱表明其有两种不同化学环境的氢(两种不同位置的氢原子),且峰面积之比为1:1。
回答下列问题:
(1)A的分子式为___________,由A→B的反应试剂和反应条件为____________。
(2)写出C→D的反应方程式:_________________________________________。
(3)同时符合下列条件的E的同分异构体共有____________种。
①分子中含有苯环 ②能发生银镜反应  ③能与FeCl3溶液发生显色反应。
③能与FeCl3溶液发生显色反应。
(4)检验F中含氧官能团的试剂为____________(填试剂名称),由F→G的反应类型为______ 。
(5)H的结构简式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-20147山东省乳山市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列关于有机物的说法正确的是
A.常在燃料乙醇中添加少量煤油以区分食用乙醇,乙醇和煤油都是石油分馏产品
B.葡萄糖、果糖的分子式虽均为C6H12O6,但二者不是同分异构体
C.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程
D.合成纤维、人造纤维及碳纤维都属于有机高分子材料
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(重庆卷解析版) 题型:填空题
(15分)(2012?重庆)金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛.
(1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子.碳元素在周期表中的位置是 ,Q是 ,R的电子式为 .
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收其中的CCl4的实验操作名称为 ,除去粗产品中少量钠的试剂为 .
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2.现将20.0g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L.生成氢气的离子方程式为 ,硅酸盐的物质的量浓度为 .
(4)下列叙述正确的有 (填序号).
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2.
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(海南卷解析版) 题型:选择题
污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
A.氨水 B.硫化氢气体
C.硫酸钠溶液 D.纯碱溶液
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(海南卷解析版) 题型:填空题
(9分)
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 :
(2)过程I 加入铁屑的主要作用是 ,分离得到固体的主要成分是 ,从固体中分离出铜需采用的方法是 ;
(3)过程II中发生反应的化学方程式为 ;
(4)过程II中调节溶液的pH为5,金属离子浓度为 。(列式计算)
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(浙江卷解析版) 题型:简答题
[14分]已知:I2+2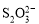

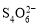 +2I―。相关物质的溶度积常数见下表:
+2I―。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2?2H2O晶体,加入 调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________________;
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2?2H2O晶体。
(2)在空气中直接加热CuCl2?2H2O晶体得不到纯的无水CuCl2,原因是_______________。(用化学方程式表示)。由CuCl2?2H2O晶体得到纯的无水CuCl2的合理方法是_______。
(3)某学习小组用“间接碘量法”测定含有CuCl2?2H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用___________作滴定指示荆,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为______________________________。
③该试样中CuCl2?2H2O的质量百分数为___________________________。
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(山东卷解析版) 题型:选择题
(3分)(2012?山东)下列实验操作正确的是( )
A.中和滴定实验时,用待测液润洗锥形瓶
B.盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
D.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com