
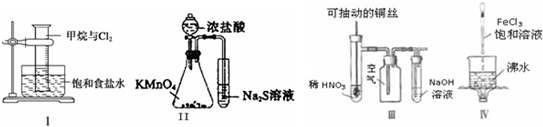
| A、实验Ⅰ:观察到量筒内黄绿色逐渐消失,量筒内壁有油状物质生成.该现象是由于甲烷与氯气在光照条件下发生了置换反应 |
| B、实验Ⅱ:可以比较KMnO4、Cl2和S氧化性的相对强弱 |
| C、实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D、实验Ⅳ:继续煮沸溶液至红褐色沉淀,停止加热,当光束通过体系时一定可产生丁达尔效应 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
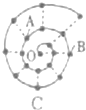 某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中0点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表-种元素,其中0点代表氢元素.下列说法中正确的是( )| A、虚线相连的元素处于同一族 |
| B、离0点越远的元素原子半径越大 |
| C、.B、C最高价氧化物的水化物可相互反应 |
| D、A、B组成的化合物中不可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室欲配制0.05mol?L-1的NaOH溶液500mL,有以下仪器:
实验室欲配制0.05mol?L-1的NaOH溶液500mL,有以下仪器:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用AgNO3鉴别工业盐(亚硝酸钠)和食盐二种溶液 |
| B、海带中碘元素提取时氧化滤液中的I-时应加入过量氯水 |
| C、将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
| D、溶质的溶解度越大,溶液的浓度越高,溶剂的蒸发速度越快,溶液的冷却速度越快,析出的晶体就越细小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4→HCl→K2S→NaOH→CO2 |
| B、Na2SO4→NaCl→Na2S→NH3?H2O |
| C、NaCl→Na2SO4→H2S→NaOH |
| D、Na2S→Na2SO4→NaCl→NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
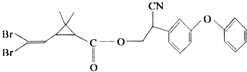 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )| A、属于芳香烃 |
| B、在一定条件下可以发生加成反应 |
| C、在碱性条件下不水解 |
| D、属于卤代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用惰性电极电解饱和食盐水初期,只需在溶液中加入适量的盐酸即可恢复至原溶液 | ||||
| B、工业上用电解熔融的氯化镁冶炼镁,也可采用电解熔融的氯化铝冶炼铝 | ||||
| C、工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上就溶解0.5NA个铜原子 | ||||
D、用惰性电极电解CuSO4溶液,有可能发生Cu2++2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:

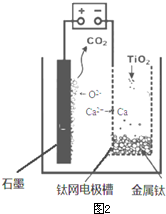
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com