
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源:不详 题型:单选题
| A.10mol | B.16mol | C.20mol | D.36mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子序数X<Y | B.原子半径X<Y |
| C.离子半径X>Y | D.原子最外层电子数X<Y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.MgCl2 | B.CaF2 | C.SiO2 | D.CS2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、—2 | —2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②④ | C.①④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
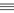 CH ④NH3 ⑤NH4+⑥BF3 ⑦P4
CH ④NH3 ⑤NH4+⑥BF3 ⑦P4 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com