
| m |
| M |
| 9g |
| 22.4L/mol |
| 9 |
| 22.4 |
| 4.8g |
| 16g/mol |
| 9 |
| 22.4 |
| 9 |
| 22.4 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、通入甲烷的电极为正极 |
| B、燃料电池工作时,溶液中的OH-离子向正极移动 |
| C、正极发生氧化反应 |
| D、该电池使用一段时间后应补充氢氧化钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 的分子式是
的分子式是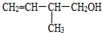 .该有机物中所含官能团的名称是
.该有机物中所含官能团的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 解释(用化学方程式表示) | |
| ① | 将充满NO2的倒立在盛有水的水槽中,拨去橡皮塞,轻轻晃动试管. | 试管内气体由 | |
| ② | |||
| ③ | 重复步骤②的操作数次,直至液体充满整个试管. | 试管内充满无色液体. | 总反应方程式: |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com