
| m |
| M |
| n |
| c |
| 0.16g |
| 40g/mol |
| 0.004mol×1 |
| 2 |
| 0.002mol |
| 0.1mol/L |


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
| A、将22.4 L氯化氢气体溶于水配成1 L溶液 |
| B、将40 g NaOH溶于1L水中配成溶液 |
| C、从1 L 1 mol/L的NaOH溶液中取出50 mL,则取出的溶液中溶质的物质的量浓度 |
| D、将1 L 10 mol/L的浓盐酸与9 L水混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
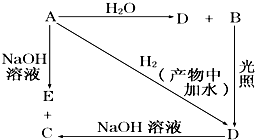 常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
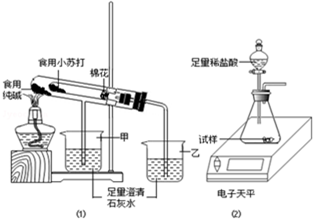 某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.| 名称 | 食用纯碱 | 食用小苏打 |
| 主要成分 | Na2CO3 | NaHCO3 |
| 酸碱性 | 水溶液显碱性 | 水溶液显碱性 |
| 热稳定性 | 受热不分解 | 270℃时完全分解为碳酸钠、二氧化碳、水 |
| 称量项目 | 称量时间 | 质量/g |
| 试样 | 11.0 | |
| 装置+稀盐酸 | 160.0 | |
| 装置+稀盐酸+试样 | 反应开始后20s | 167.0 |
| 装置+稀盐酸+试样 | 反应开始后30s | 166.6 |
| 装置+稀盐酸+试样 | 反应开始后90s | 166.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
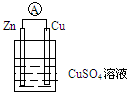 根据如图装置回答:
根据如图装置回答:查看答案和解析>>
科目:高中化学 来源: 题型:
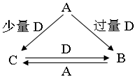 A、B、C、D均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则A不可能是( )
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则A不可能是( )| A、金属单质 | B、非金属单质 |
| C、两性氧化物 | D、碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com