
 某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:
某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:| A. | 溶液中一定含有NH4+、C032- | |
| B. | 溶液中离子浓度c(Na+)=c(S042一) | |
| C. | 溶液中一定不含Mg2+、Al3+、Fe3+ | |
| D. | 溶液可能是由Na2C03与(NH4)2S04组成的混合溶液 |
分析 某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032-中的若干离子,由于溶液无色,故不含Fe3+;
(1)向溶液中加入足量的盐酸,生成2.24L无色无味的气体,故此气体是CO2,故一定含C032-,并能据此确定C032-的物质的量为0.1mol,且和C032-不能共存的离子不能有;此气体不是SO2,据此可知不能含S032-、S2032-;
(2)由于溶液中含0.1molC032-,故当加入足量的氯化钡时,产生的沉淀中一定含0.1molBaCO3,但质量仅为19.7g,据此可知溶液中含一定含S042-,并根据BaSO4的质量换算成物质的量,即可知S042-的物质的量也为0.1mol;
(3)加入足量的NaOH溶液后,生成4.48L气体即氨气,据此可知溶液中含NH4+和其物质的量,然后根据溶液的电中性来确定Na+的存在,据此分析.
解答 解:某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032-中的若干离子,由于溶液无色,故不含Fe3+;
(1)向溶液中加入足量的盐酸,生成2.24L无色无味的气体,则此气体是CO2,则一定含C032-,由于气体的物质的量为0.1mol,可知C032-的物质的量为0.1mol,由于Mg2+、Al3+均和C032-不能共存,故溶液中无Mg2+、Al3+;由于此气体无味,故此气体不是SO2,故溶液中不能含S032-、S2032-;
(2)加入足量的氯化钡溶液后,生成43.0g沉淀.由于溶液中含0.1molC032-,故当加入足量的氯化钡时,产生的沉淀中一定含0.1molBaCO3,质量仅为19.7g,据此可知溶液中除了含0.1molC032-还一定含S042-,且生成的BaSO4的质量为m=43.0g-19.7g=23.3g,物质的量为n$\frac{23.3g}{233g/mol}$=0.1mol,故溶液中S042-的物质的量为0.1mol;
(3)加入足量的NaOH溶液后,生成4.48L气体,则气体为氨气,由于氨气的物质的量为0.2mol,可知溶液中含NH4+且其物质的量为0.2mol,而溶液一定呈电中性,故溶液中Na+一定存在,且物质的量为0.2mol.
即溶液中含0.2molNH4+、0.2molNa+、0.1molC032-、0.1molS042-,不含Mg2+、Al3+、Fe3+、S032-、S2032-.
A、溶液中一定含有NH4+、C032-,故A正确;
B、溶液中离子浓度c(Na+)=2c(S042-)=$\frac{0.2mol}{0.1L}$=2mol/L,故B错误;
C、溶液中一定不含Mg2+、Al3+、Fe3+,故C正确;
D、由于溶液中含0.2molNH4+、0.2molNa+、0.1molC032-、0.1molS042-,故可以看做是Na2C03与(NH4)2S04组成的混合液,故D正确.
故选B.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,试题培养了学生的分析能力及灵活应用能力.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
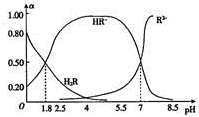 室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )
室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )| A. | H2R的一级电离平衡常数Kal≈0.25 | |
| B. | pH=2.5的H2R溶液中:c(HR-)+2c(R2-)+c(OH-)=l0-2.5 | |
| C. | pH=5.5的该溶液中:c(HR一)>c(R2一)>c(H+)>c(OH一) | |
| D. | 向pH=7的该溶液中滴加少量稀硫酸,a(HR-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
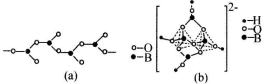
| A. | 配合物中中心原子的电荷数和配位数均为6 | |
| B. | 该配合物可能是平面正方形结构 | |
| C. | 4个Cl-和2个NH3分子均与Pt4+配位 | |
| D. | 配合物中4个Cl-与Pt4+配位,而2个NH3分子与Pt4+不配位 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
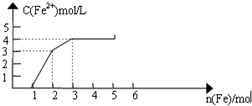 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )| A. | 1:8 | B. | 1:9 | C. | 3:8 | D. | 1:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
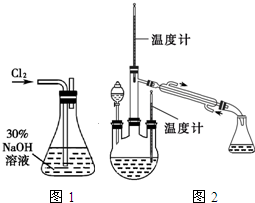 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com