
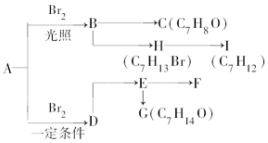
 A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体:
A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体: ,
, .
.分析 分子式为C7H8的芳香烃一定是甲苯,即A的结构简式是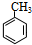 .在光照下,甲苯和单质溴发生甲基上的取代反应,结合H的分子式可知,发生一溴取代,所以B的结构简式是
.在光照下,甲苯和单质溴发生甲基上的取代反应,结合H的分子式可知,发生一溴取代,所以B的结构简式是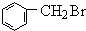 .卤代烃水解得到醇,故C是
.卤代烃水解得到醇,故C是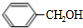 ,B到H从分子式的变化来看,H比B多了6个氢原子,因此B和氢气加成生成了H,则H结构简式为
,B到H从分子式的变化来看,H比B多了6个氢原子,因此B和氢气加成生成了H,则H结构简式为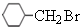 ,H到I少了1个氢原子和1个溴原子,因此发生的是消去反应,则I为
,H到I少了1个氢原子和1个溴原子,因此发生的是消去反应,则I为 .D是A的对位一取代物,则D的结构简式为:
.D是A的对位一取代物,则D的结构简式为: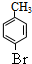 ,H与E互为同分异构体,则D与氢气发生加成反应生成E为
,H与E互为同分异构体,则D与氢气发生加成反应生成E为 ,I与F分别互为同分异构体,则E发生消去反应生成F为
,I与F分别互为同分异构体,则E发生消去反应生成F为 ,由G的分子式可知,E发生水解反应生成G,则G的结构简式为
,由G的分子式可知,E发生水解反应生成G,则G的结构简式为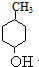 ,据此解答.
,据此解答.
解答 解:(1)由上述分析可知,化合物I的结构简式是 ,反应B→C的化学方程式是
,反应B→C的化学方程式是 ,
,
故答案为: ;
; ;
;
(2)证明溴代烃中含有溴原子,可以先再碱性条件下发生水解反应,再由硝酸酸化的硝酸银检验溴离子,生成淡黄色沉淀,说明含有溴元素,所需要的试剂:NaOH溶液,HNO3、AgNO3,故答案为:NaOH溶液,HNO3、AgNO3;
(3)E→F是消去反应,E→G是水解反应,
A.消去反应、水解反应均有溴离子生成,故A错误;
B.因为混合液中含有氢氧化钠,因此加入溴水,溴水会和氢氧化钠反应颜色也会褪去,B错误;
C.反应后的混合液中加入盐酸酸化后,加入溴的CCl4溶液,溶液褪色,说明消去反应生成碳碳双键,故C正确;
D.酸性高锰酸钾溶液也会氧化溴离子而褪色,故D错误,
故答案为:C.
点评 本题考查有机物推断,判断A为甲苯,再充分根据有机物分子式进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D>C>B>A | |
| B. | 原子序数:D>C>B>A | |
| C. | 原子半径:A>B>C>D | |
| D. | 最高价氧化物的水化物碱性:A>B,酸性:C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | t/min C/mol•L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 盐酸滴在石灰石上:CO32-+2H+=CO2↑+H2O | |
| D. | 铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下电离常数为Ka的酸HA 溶液中 c (H+)=$\sqrt{{K}_{a}}$mol•L-1 | |
| B. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) | |
| C. | 0.2mol•L-1 CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合2c(H+)-2c(OH-)═c(CH3COO-)-c(CH3COOH) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸的反应:2Fe+6H +═2Fe 3 ++3 H 2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO 3+2H +═Ca 2 ++2H 2O+CO 2↑ | |
| C. | 铜片插入硝酸银溶液:Cu+Ag +═Cu 2++Ag | |
| D. | 钠与水反应::2Na+2H 2O═2OH -+2Na ++H 2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温缩小体积,平衡向右移动,再次达平衡时颜色比原平衡浅 | |
| B. | 恒容升温,逆反应速率加快,正反应速率减慢 | |
| C. | 若改变条件使平衡向右移动,则该反应的平衡常数将增大 | |
| D. | 恒温恒容,充入少量NO2,再次达平衡时NO2的转化率比原平衡的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:d>c | |
| B. | 单质的沸点:a<b | |
| C. | b、d的氧化物对应的水化物均为强酸 | |
| D. | b、c可形成离子化合物b3c2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com