
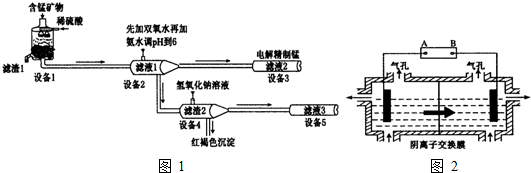
 Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.分析 锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等,用硫酸溶解,SiO2不硫酸反应,MnCO3、FeCO3、Al2O3与硫酸反应得到MnSO4、FeSO4、Al2(SO4)3,而滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2,酸性条件下MnO2将Fe2+离子氧化为Fe3+离子,过滤除去二氧化硅等不溶物,滤渣1为SiO2等不溶物.滤液1中加入过氧化氢将Fe2+离子氧化为Fe3+离子,再加入氨水调节溶液pH使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤液2中含有MnSO4、NH4SO4等,滤渣2为Fe(OH)3、Al(OH)3,向滤渣2中加入氢氧化钠,氢氧化铝溶解得到NaAlO2,过滤分离.滤液2电解得到Mn,
(1)滤渣1的主要成分是二氧化硅;
(2)设备1中发生氧化还原反应:二氧化锰在酸性条件下将+2价铁氧化为铁离子,二氧化硫被还原得到Mn2+;
(3)设备2中加足量双氧水将Fe2+离子氧化为Fe3+离子;利用加入铁氰化钾溶液检验Fe2+离子;
(4)Al(OH)3存在电离平衡:Al3++3OH- Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,平衡正向移动,氢氧化铝被溶解;
AlO2-+H++H2O,加入NaOH溶液,H+被中和,平衡正向移动,氢氧化铝被溶解;
(5)①电解装置中箭头表示溶液中阴离子移动的方向,则左室为阴极室,右室为阳极室,A为电源的负极,B为电源的阳极,阳极以稀硫酸为电解液,溶液中氢氧根离子放电生成氧气;
②Mn2+进入阳极区,发生氧化反应生成MnO2,需要有水参与反应,根据电荷守恒可知有氢离子生成.
解答 解:锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等,用硫酸溶解,SiO2不硫酸反应,MnCO3、FeCO3、Al2O3与硫酸反应得到MnSO4、FeSO4、Al2(SO4)3,而滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2,酸性条件下MnO2将Fe2+离子氧化为Fe3+离子,过滤除去二氧化硅等不溶物,滤渣1为SiO2等不溶物.滤液1中加入过氧化氢将Fe2+离子氧化为Fe3+离子,再加入氨水调节溶液pH使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤液2中含有MnSO4、NH4SO4等,滤渣2为Fe(OH)3、Al(OH)3,向滤渣2中加入氢氧化钠,氢氧化铝溶解得到NaAlO2,过滤分离.滤液2电解得到Mn.
(1)滤渣1的主要成分是SiO2,故答案为:SiO2;
(2)设备1中发生氧化还原反应:二氧化锰在酸性条件下将+2价铁氧化为铁离子,二氧化硫被还原得到Mn2+,反应离子方程式为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 或2FeCO3+MnO2+8H+=2Fe3++Mn2++CO2↑+4H2O,
故答案为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 或2FeCO3+MnO2+8H+=2Fe3++Mn2++CO2↑+4H2O;
(3)设备2中加足量双氧水将Fe2+离子氧化为Fe3+离子,便于调节pH时转化为沉淀除去,检验滤液2中是否存在Fe2+的方案为:取滤液2,加入铁氰化钾溶液,如果有蓝色沉淀产生,则有Fe2+,否则没有Fe2+,
故答案为:将Fe2+完全氧化为Fe3+;取滤液2,加入铁氰化钾溶液,如果有蓝色沉淀产生,则有Fe2+,否则没有Fe2+;
(4)滤渣2中存在Al(OH)3,存在电离平衡:Al3++3OH- Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解,
AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解,
故答案为:滤渣2中存在Al(OH)3,存在电离平衡:Al3++3OH- Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解;
AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解;
(5)①电解装置中箭头表示溶液中阴离子移动的方向,则左室为阴极室,右室为阳极室,A为电源的负极,B为电源的阳极,阳极以稀硫酸为电解液,溶液中氢氧根离子放电生成氧气,电极反应为:4OH--4e-=2H2O+O2↑,
故答案为:负极;4OH--4e-=2H2O+O2↑;
②Mn2+进入阳极区,发生氧化反应生成MnO2,需要有水参与反应,根据电荷守恒可知有氢离子生成,该副反应的电极反应式:Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2++2H2O-2e-=MnO2+4H+.
点评 本题考查学生对工艺流程的理解、阅读题目获取信息能力、物质的分离提纯、化学平衡移动、电解原理等,综合性较大,难度中等,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
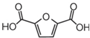 )可以替代化石燃料衍生物对苯二甲酸,与乙二醇合成材料聚2,5-呋喃二甲酸乙二醇酯(PEF).下列说法正确的是( )
)可以替代化石燃料衍生物对苯二甲酸,与乙二醇合成材料聚2,5-呋喃二甲酸乙二醇酯(PEF).下列说法正确的是( )| A. | 合成PEF的反应为加聚反应 | |
| B. | PEF不能与氢气发生加成反应 | |
| C. | 聚对苯二甲酸乙二醇酯的结构简式为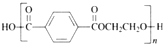 | |
| D. | 通过红外光谱法测定PEF的平均相对分子质量,可得其聚合度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
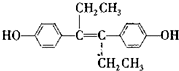 )是一种激素类药物,下列说法正确的是( )
)是一种激素类药物,下列说法正确的是( )| A. | R是芳香烃 | B. | R含2种含氧官能团 | ||
| C. | 1 mol R最多与1 mol H2加成 | D. | R能发生加成、取代和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合成聚碳酸酯可降解塑料,可以减少“白色污染” | |
| B. | 用蘸有浓氨水的棉棒可以检验输送氯气的管道是否漏气 | |
| C. | 农作物秸秆处理起来麻烦,利用价值低,适于就地露天焚烧 | |
| D. | 推广矿物燃料脱硫脱硝技术,能有效减少二氧化硫和氮氧化物的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
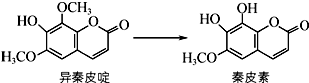 异秦皮啶具有抗肿瘤功效,秦皮素具有抗痢疾杆菌功效.它们在一定条件下可发生如图所示的转化.下列说法正确的是( )
异秦皮啶具有抗肿瘤功效,秦皮素具有抗痢疾杆菌功效.它们在一定条件下可发生如图所示的转化.下列说法正确的是( )| A. | 异秦皮啶与秦皮素互为同系物 | |
| B. | 鉴别异秦皮啶与秦皮素可用溴水 | |
| C. | 1 mol秦皮素最多可与3 mol NaOH反应 | |
| D. | 每个异秦皮啶分子与氢气完全加成后的产物中含有5个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
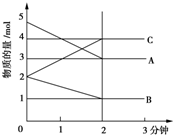 某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体),该反应的化学方程式为2A+B?2C.
某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体),该反应的化学方程式为2A+B?2C.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com