
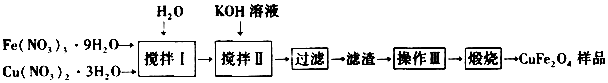
���� ���ᾧˮ��������������ͭ����ˮ��Ȼ������Һ�м���KOH��������Һ��pH=4������Fe��OH��3��Cu��OH��2���������˽�����ϴ�ӡ�����Ȼ�����յõ�CuFe2O4��
��1����������ˮ��Һ�з�����ˮ����������������
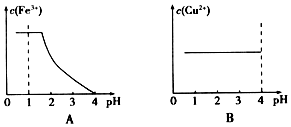
��2�������ܶȻ�������������������������ͭ������ȫ����ҺPH�����жϣ�
��3���������ǹ��˵õ�����������ϴ�Ӹ���������գ�
��4����ȱλ����ˮ��Ӧ�����������ͭ��CuFe2O4��������ԭ���غ���д��ƽ��
��5��������ͭ��Ʒ��N2�������г�����գ�����ȱλ�������Ϊԭ������96.6%��CuFe2O4-a������ΪCuFe2O4��96.6%���ݴ���ʽ���㣻
��� �⣺��1���������������Һ��Fe��NO3��3��Cu��NO3��2��������ˮ����������������������Ԫ�صĴ�����ʽΪFe3+��Fe��OH��3��
�ʴ�Ϊ��Fe��OH��3��
��2�������������Һ��Fe��NO3��3��Cu��NO3��2�����ʵ���Ũ�ȷֱ�Ϊ2.6mol•L-1��1.3mol•L-1��������ȫ������Ũ��С��10-5mol/L
��֪��Ksp[Fe��OH��3]=2.6��10-39��c��OH-��=$\root{3}{\frac{2.6��1{0}^{-39}}{1{0}^{-5}}}$=6.4��10-12mol/L��c��H+��=1.6��10-3mol/L��PH=3-lg1.6��2.8��ͼ���������ӳ�����ȫ��PH����Ksp[Cu��OH��2]=2.2��10-20����Һ������������Ũ��c��OH-��=$\sqrt{\frac{2.2��1{0}^{-20}}{1{0}^{-5}}}$=4.7��10-8mol/L��c��H+��=$\frac{1{0}^{-14}}{4.7��1{0}^{-8}}$=2.1��10-7mol/L��PH��6.7��ͼ��B���ϣ�
�ʴ�Ϊ��B��
��3���������ǹ��˵õ�����������ϴ�Ӹ���������գ�������Ϊϴ�ӡ����
�ʴ�Ϊ��ϴ�ӡ����
��4����ȱλ����ˮ��Ӧ����Ļ�ѧ����ʽΪCuFe2O4-a+aH2O=CuFe2O4+aH2����
�ʴ�Ϊ��CuFe2O4-a+aH2O=CuFe2O4+aH2����
��5��������ͭ��Ʒ��N2�������г�����գ�����ȱλ�������Ϊԭ������96.6%��CuFe2O4-a������ΪCuFe2O4��96.6%��$\frac{CuF{e}_{2}{O}_{4-a}}{CuF{e}_{2}{O}_{4}}$��100%=96.6%
a=0.51��
�ʴ�Ϊ��0.51��
���� ���⿼�������ʷ����ᴿ�ķ����������ܶȻ������ļ�������жϣ�������ʵ������Ӧ�ã�ע�ⷴӦ������ԭ���غ������Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ų���Һ�ĵζ��ܿ�ʼ�����ݣ�����Һ���������ʧ | |
| B�� | �ζ���������ˮϴ�Ӻ�ֱ��ע�����Һ���еζ� | |
| C�� | ��ƿ������ˮϴ�Ӻ�ֱ�Ӽ��������Һ�ζ� | |
| D�� | �ζ���������ˮϴ�Ӻ�ֱ��ע�����Һ��ȡ20.00 mL���еζ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ��Ŀ�� | ʵ����� | |
| A | ����1.0mol/L CuSO4��Һ | ��25g������������ˮ���100mL��Һ |
| B | ֤��ij��Һ�к���SO42- | �����Һ�е���BaCl2��Һ |
| C | ʵ�����ƴ���CO2 | ��ϡ�����м������ʯ |
| D | �Ʊ�Fe��OH��3���� | �����͵�FeCl3��Һ�μӵ���NaOH��Һ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪Ǧ���صĹ���ԭ��ΪPb+PbO2+2H2SO4$?_{���}^{�ŵ�}$2PbSO4+2H2O��������ͼװ�ý��е�⣨���Һ����������õ�Ǧ������ת��0.4mol����ʱ���缫����������11.2g����ش� �������⣮
��֪Ǧ���صĹ���ԭ��ΪPb+PbO2+2H2SO4$?_{���}^{�ŵ�}$2PbSO4+2H2O��������ͼװ�ý��е�⣨���Һ����������õ�Ǧ������ת��0.4mol����ʱ���缫����������11.2g����ش� �������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ���� | �����Լ� | ���ӷ���ʽ |
| A | NH4+��Mg2+��SO42- | ����Ba��OH��2��Һ | NH4++SO42-+Ba2++OH-=BaSO4��+NH3•H2O |
| B | Mg2+��HCO3-��Cl- | ����NaOH��Һ | Mg2++2HCO3-+2OH-=MgCO3-��+CO32-+2H2O |
| C | H+��Na+��NO3- | Fe�� | Fe+2H+=Fe2++H2�� |
| D | Ca2+��NH3•H2O��Cl- | ͨ�����CO2 | NH3•H2O+CO2=NH4++HCO3- |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | Cu��OH��2 | Fe��OH��3 | CuCl | CuI |
| Ksp | 2.2��10-20 | 2.6��10-39 | 1.7��10-7 | 1.3��10-12 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com