
【题目】“电芬顿法”除去水体里有机污染物的原理如图所示,发生电芬顿反应:Fe2++H2O2== Fe3++OH-+·OH,生成的羟基自由基(·OH)能降解有机污染物。下列说法正确的是
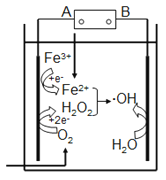
A. 电源的A极是正极,B极是负极
B. 阴极上O2、Fe3+、H2O2得电子发生还原反应
C. 阳极上发生电极反应:H2O-e-==OH+H+
D. 常温常压下,消耗22.4LO2,可以产生4mol·OH
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体![]() 呈立方体结构。如图为超氧化钾晶体的一个晶胞
呈立方体结构。如图为超氧化钾晶体的一个晶胞![]() 晶体中最小的重复单元
晶体中最小的重复单元![]() 则有关下列说法正确的是()
则有关下列说法正确的是()

A.![]() 中只存在离子键
中只存在离子键
B.晶体中,所有原子之间都是以离子键结合
C.晶体中与每个![]() 距离最近的
距离最近的![]() 有6个
有6个
D.超氧化钾化学式为![]() ,每个晶胞含有1个
,每个晶胞含有1个![]() 和1个
和1个![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2A为二元弱酸。常温下,向20mL0.1molL-1的H2A溶液中逐滴加入0.2molL-1的NaOH溶液,溶液中水电离的c水(OH-)随加入NaOH溶液的体积变化如图所示,下列说法中错误的是( )
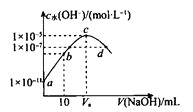
A.Va=20
B.b点溶液中存在:c(Na+)>c(HA-)>c(H+)>c(OH-)
C.Ka2(H2A)的数量级为10-6
D.d点溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L1H2(g)、0.5mol·L1 I2(g)及0.3mol·L1HI(g),则下列说法中正确的是
2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L1H2(g)、0.5mol·L1 I2(g)及0.3mol·L1HI(g),则下列说法中正确的是
A.反应正好达到平衡
B.反应向左进行
C.反应向某方向进行一段时间后K<57.0
D.反应向某方向进行一段时间后c(H2)<0.2mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.24L(标准状况)某气态烃在足量的氧气中完全燃烧,将产物通入足量的澄清石灰水中,得到20g沉淀;若用足量碱石灰吸收这些燃烧产物,固体质量增重12.4g。通过计算确定该烃的分子式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol/LH2A溶液中逐滴加入等浓度NaOH溶液,所得溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图,下列说法中正确的是( )
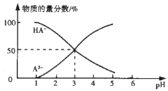
A.H2A的电离方程式为H2A=HA-+H+ HA-A2-+H+
B.室温下,Na2A水解平衡常数Kh=10-11
C.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)<0.1mol/L
D.常温下,等物质的量浓度NaHA与Na2A溶液等体积混合后溶液的pH=3.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究。完成下列空格。
①提出假设:
假设1:只存在Fe2O3;假设2:_________;假设3:既存在Fe2O3也存在Cu2O。
②查找资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
③实验方案设计与分析:
方案一:步骤一:取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出假设____不成立,写出产生上述气体的化学方程式___________________。
步骤二:取少量步骤一溶液置于试管中滴加_______,振荡,若________,则说明假设3成立。
方案二:
取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,说明假设_不成立。
方案三:
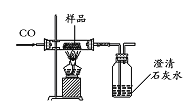
同学们设计了如下实验方案测定该样品中Fe2O3的质量分数(装置气密性良好,假设样品完全反应):
步骤一:取样品并称量该样品的质量为m1;
步骤二:测出反应前广口瓶和瓶内物质总质量m2;
步骤三:测出反应后广口瓶和瓶内物质总质量m3;
步骤四:计算得出矿物样品中Fe2O3的质量分数。
讨论分析:该实验方案________(填“能”或“不能”)测出矿物中Fe2O3的质量分数。不改变装置和药品,通过计算得出矿物中Fe2O3的质量分数,你还可以通过测定_______。若测得m1为3.04g,m3=m2+1.76g,则原样品中Fe2O3的质量分数为_____(结果保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的基础。
(1)将氨的催化氧化反应的化学方程式补充完整:4NH3+5O2![]() ________。
________。
(2)氨的催化氧化反应说明氨具有________性(填“氧化”或“还原”)。
(3)除(2)中性质外,氨还具有________的化学性质,并列举一个氨表现该性质的反应;________(写出反应的化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种简单的原电池装置如下图所示。据图回答下列问题。
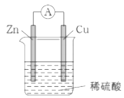
(1)锌是该电池的_______(填“正”或“负”)极。Zn片上发生的电极反应为_______。Cu片上发生的电极反应为__________。能证明化学能转化为电能的实验现象为______。
(2)装置中稀硫酸的作用是_______。
A.电极材料 B.电极反应物 C.电子导体 D.离子导体
(3)某原电池的总反应是Zn+Cu2+=Zn2++Cu,该原电池的正确组成是______。
A.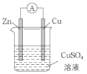 B.
B.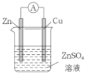 C.
C.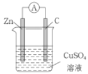 D.
D.
(4)从化学的角度分析,原电池装置产生电流的原因是:原电池装置可将____,并通过能导电的物质形成闭合回路,产生电流
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com