
【题目】铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCoO2、 LiFePO4常用作锂离子电池的正极材料。
基态Co原子核外电子排布式为___________________,第四电离能I4(Co) _________I4(Fe)(填“>”或“<”),PO43-的空间构型为___________________。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。在CO分子中,σ键与π键数目之比为_________。
(3)铁与K2O、 (环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,配体配位数为 ________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________晶体。
(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,配体配位数为 ________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________晶体。
(4)与铁同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种,往其溶液中加BaCl2溶液时,有白色沉淀;加入AgNO3溶液时,没有沉淀生成;加入氢氧化钠溶液时,无气体生成。则此种配合物的化学式为 _________________________。
(5)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
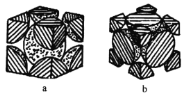
在图a所示堆积方式里铁原子的堆积方式为___________________________。
在图b所示堆积方式里铁原子的总体积占晶体体积的比例为(空间利用率)_________。
【答案】[Ar]3d74s2 < 正四面体 1:2 3 分子 [Co(NH3)5Br]SO4 体心立方堆积 ![]()
【解析】
(1)Co为27号元素,根据构造原理写出原子核外电子排布式;
Co3+核外电子排布为不稳定结构3d6、较易失去电子,Fe3+核外电子排布为半满稳定结构3d5,较难失电子,由此比较第4电离能;
PO43-中P原子孤电子对数为0、σ键数目为4,由此确定空间构型;
(2)价电子数和原子数相等的粒子互为等电子体;CO与N2的结构相似,σ键、π键数分别为1、2;
(3)在环戊二烯中有4个C原子为sp2杂化,1个C原子为sp3杂化,C5H5 - 五个C拿出5个电子再加上负离子一个电子,所以一共有六个电子,配位数为3;二茂铁的熔点不高、溶解性情况包括能升华等性质与分子晶体相似;即二茂铁由分子构成,是共价化合物,属于分子晶体;
(4)根据配合物的性质确定其内界和外界;
(5)图a晶胞为体心立方堆积,设晶胞棱长为x,则4rpm=![]() x,求出x;
x,求出x;
图b晶胞为面心立方最密堆积,设b晶胞棱长为y,Fe原子半径为R,4R=![]() y,再结合球体积公式计算。
y,再结合球体积公式计算。
(1)Co为27号元素,原子核外电子排布式为[Ar]3d74s2;
Co3+核外电子排布为不稳定结构3d6、较易失去电子,第四电离能较小;而Fe3+核外电子排布为半满稳定结构3d5,较难失电子,所以第4电离能较大;
PO43-中P原子孤电子对数为0、σ键数目为4,所以PO43-的空间构型为正四面体;
故答案为:[Ar]3d74s2,<,正四面体;
(2)CO的价电子数为(4+6)=10,原子数为2,N2的价电子数为10=5×2,所以CO的等电子体为N2 等;CO与N2的结构相似,根据N2的结构式N≡N可知,CO分子中含有一个σ键、两个π键数,所以在CO分子中,σ键与π键数目之比为1:2;
故答案为:1:2;
(3)在环戊二烯中有4个C原子为sp2杂化,1个C原子为sp3杂化,C5H5 - 五个C拿出5个电子再加上负离子一个电子,所以一共有六个电子,配位数为3;根据二茂铁的熔点不高、溶解性情况、能升华等性质与分子晶体相似,即二茂铁由分子构成,是共价化合物,属于分子晶体;
故答案为:3;分子;
(4)与铁同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种,往其溶液中加BaCl2溶液时,有白色沉淀,说明硫酸根离子在处界;加入AgNO3溶液时,没有沉淀生成,说明Br在内界;加入氢氧化钠溶液时,无气体生成,说明氨在内界。则此种配合物的化学式为[Co(NH3)5Br]SO4,故答案为:[Co(NH3)5Br]SO4;
(5)图a晶胞为体心立方堆积,设图a晶胞棱长为x,4rpm=![]() x,x=
x,x=![]() r×10-10cm;
r×10-10cm;
设图b晶胞棱长为y,Fe原子半径为R,晶胞中Fe数目为8×![]() +6×
+6×![]() =4,4R=
=4,4R=![]() y,R=
y,R=![]() ,球体积V=
,球体积V=![]() πR3=
πR3=![]() π×(
π×(![]() )3,原子的总体积占晶体体积的比例=
)3,原子的总体积占晶体体积的比例= ×100%=
×100%=![]() ;
;
故答案为:体心立方堆积;![]() 。
。


科目:高中化学 来源: 题型:
【题目】常温下,向20 mL的某稀盐酸中滴入0.1 mol·L-1的羟胺溶液, 羟胺的电离方程式为:NH2OH+H2O ![]() NH3OH++OH-(25℃常温时, Kb=9.0×l0-9)。溶液中由水电离出的氢离子浓度随滴入羟胺溶液体积的变化如图(已知:lg3=0.5),下列分析正确的是
NH3OH++OH-(25℃常温时, Kb=9.0×l0-9)。溶液中由水电离出的氢离子浓度随滴入羟胺溶液体积的变化如图(已知:lg3=0.5),下列分析正确的是
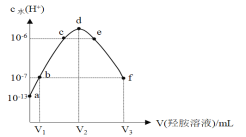
A.0.1 mol·L-1羟胺溶液的 pH=8.5B.b点溶液中:c(H+) =c(OH-)
C.d点对应溶液中存在:c(H+)=c (OH-)+c (NH2OH)D.该稀盐酸的浓度为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有Fe2+、Fe3+,分别表示为 Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用 H2消除酸性废水中的致癌物 NO2-,其反应过程示意图如图所示,下列说法不正确的是
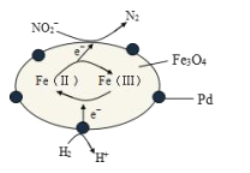
A.用该法处理后水体的 pH降低
B.Fe(Ⅱ)与 Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被 Fe(Ⅱ)还原为 N2
D.Pd 上发生的电极反应为:H2- 2e-== 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
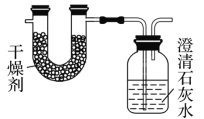
实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
(石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
根据实验数据完成下列问题:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为________g。
(2)生成的二氧化碳中碳元素的质量为________g。
(3)该燃料中碳元素与氢元素的质量比为________。
(4)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是产生雾霾的主要因素,对废气的综合治理是当前“打赢蓝天保卫战”的重要举措。

(1)利用某些催化剂,可实现将空气中的碳氧化物和氮氧化物转化为无毒的大气可循环物质。
已知:①N2(g)+O2(g)2NO(g)△H1=+180.5kJmol-1
②2C(s)+O2(g)2CO(g)△H2=-221.0kJmol-1
③C(s)+O2(g)CO2(g)△H3=-393.5kJmol-1
则反应2NO(g)+2CO(g)N2(g)+2CO2(g)的△H=______kJmol-1;某温度下,反应①、②、③的平衡常数分别为K1、K2、K3表示,则该反应的平衡常数K=______(用K1、K2、K3表示)。
(2)在同温同压下,一定量的NO和CO在不同催化剂条件下反应的能量变化如图所示。当反应进行相同的时间时,测得催化剂______(填“1”或“2”)条件下NO转化率更高,其原因是______。

(3)一定温度下,向体积为1L的密闭容器中充入NO和CO的混合气体2mol,在催化剂作用下发生反应2NO(g)+2CO(g)N2(g)+2CO2(g),达到平衡时,NO、CO的转化率及N2的体积分数为![]() 的关系如图所示,表示NO转化率的曲线为______(填“a”或“b”),该反应的平衡常数K=______。
的关系如图所示,表示NO转化率的曲线为______(填“a”或“b”),该反应的平衡常数K=______。

(4)利用如图所示的电解装置能将NO变废为宝,其中a、b为惰性电极。电极a的电极反应式为______。每转移3mol电子,溶液中通过质子交换膜的离子的物质的量是______mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)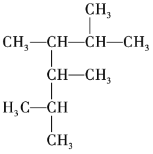 的名称为______。
的名称为______。
(2) 的名称为______。
的名称为______。
(3)3-甲基-2-戊烯的结构简式为______。
(4)1,3,5-三甲基苯的结构简式为______。
(5)某烷烃的相对分子质量为72,其一氯代物只有一种,该烷烃的结构简式为______。
(6)2,3-二甲基-2-丁烯的键线式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是
A. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键
B. 乳酸有一对对映异构体,因为其分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”解释
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 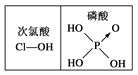
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
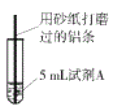
实验序号 | 试剂A | 实验现象 |
1 | 0.2mol/LCuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
3 | 2mol/LCuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
4 | 2mol/LCuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
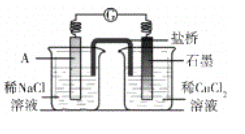
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号 | 实验操作 | 实验现象 |
i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由无色变为褐色 |
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com