考点:化学方程式的有关计算,化学平衡的影响因素,等效平衡,化学平衡的计算,难溶电解质的溶解平衡及沉淀转化的本质,二氧化硫的化学性质
专题:计算题,化学平衡专题
分析:(1)SO
2和Cl
2组成的混合气体通入Fe
2(SO
4)
3溶液中,由于氯气的氧化性强于铁离子,故氯气先与二氧化硫反应:SO
2+Cl
2+2H
2O=2HCl+H
2SO
4,充分反应后,溶液的棕黄色变浅,说明铁离子氧化二氧化硫:2Fe
3++SO
2+H
2O=SO
42-+2Fe
2++2H
+,二氧化硫完全反应,反应后的溶液足量的BaCl
2溶液,生成的22.3g沉淀为BaSO
4,其物质的量为0.1mol,根据硫元素守恒可知n(BaSO
4)=3n[Fe
2(SO
4)
3]+n(SO
2),据此计算n(SO
2),进而计算二氧化硫的体积;
当铁离子完全反应时,混合气体的体积最最小,计算Fe
3+离子氧化的SO
2,剩余的SO
2由氯气氧化,进而计算混合气体最小体积;当混合气体SO
2和Cl
2恰好完全反应时,混合气体的体积最大;
(2)根据热化学方程式,可知每生成1mol SO
3放出98 kJ热量,当放出196 kJ热量时生成2 mol SO
3,利用三段式计算平衡时各组分的物质的量,根据K=
计算;
(3)温度不变情况下,平衡常数不变,增大任一组分的浓度,平衡时各组分的浓度都增大;若只改变温度,平衡常数分数变化,平衡时各组分的浓度,有的增大、有的减小;保持温度和容器体积不变,充入不参与反应的气体,平衡不移动,各组分的浓度不变;
(4)等体积混合后硫酸根为1.0×10
-3mol/L,根据溶度积计算Ba
2+离子最小浓度,进而计算BaCl
2溶液的最小浓度;
(5)SO
2的漂白原理是与有色物质化合生成无色不稳定的化合物,SO
2使酸性KMnO
4褪色,是SO
2表现还原性而不是漂白性;KMnO
4酸性条件下的还原产物为Mn
2+化合价降低5,SO
2被氧化成SO
42-化合价升高2,根据电子转移守恒计算.
解答:
解:(1)SO
2和Cl
2组成的混合气体通入Fe
2(SO
4)
3溶液中,由于氯气的氧化性强于铁离子,故氯气先与二氧化硫反应:SO
2+Cl
2+2H
2O=2HCl+H
2SO
4,充分反应后,溶液的棕黄色变浅,说明铁离子氧化二氧化硫:2Fe
3++SO
2+H
2O=SO
42-+2Fe
2++2H
+,二氧化硫完全反应,反应后的溶液足量的BaCl
2溶液,生成的16.31g沉淀为BaSO
4,其物质的量=
=0.1mol,根据硫元素守恒可知n(BaSO
4)=3n[Fe
2(SO
4)
3]+n(SO
2),故n(SO
2)=0.1mol-3×0.2L×0.1mol?L
-1=0.04mol,V(SO
2)=0.04mol×22.4L/mol=0.896L;
当铁离子完全反应时,混合气体的体积最小,n(Fe
3+)=2×0.2L×0.1mol?L
-1=0.04mol,可以氧化的SO
2为0.02mol,故被氯气氧化SO
2为0.04mol-0.02mol=0.02mol,需要氯气的物质的量为0.02mol,则混合气体的最小体积大于(0.04mol+0.02mol)×22.4L/mol=1.344L,当混合气体SO
2和Cl
2恰好完全反应时,混合气体的体积最大,混合气体的最大体积小于(0.04mol+0.04mol)×22.4L/mol=1.792L,故a的取值范围为0.896<a<1.792,
故答案为:0.896;0.896<a<1.792;
(2)根据热化学方程式每生成1mol SO
3放出98 kJ热量,当放出196 kJ热量时生成2 mol SO
3 SO
2(g)+
O
2(g)

SO
3(g)
初始(mol):4 10 0
变化(mol):2 1 2
平衡(mol):2 9 2
平衡常数k=
=
故答案为:
;
(3)A.保持温度和容器体积不变,充入2mol SO
3,平衡向逆反应分析移动,则SO
2、O
2、SO
3气体平衡浓度都比原来增大,故A正确;
B.保持温度和容器体积不变,充入2mol N
2,对平衡移动没有影响,各物质的浓度不变,故B错误;
C.保持温度和容器体积不变,充入0.5mol SO
2和0.25mol O
2,平衡向正反应方向移动,则SO
2、O
2、SO
3气体平衡浓度都比原来增大,故C正确;
D.保持温度和容器内压强不变,充入1mol SO
3,处于等效平衡状态,浓度不变,故D错误;
E.升高温度,平衡向逆反应分析移动,SO
3的浓度减小,故E错误;
F.移动活塞压缩气体,体积减小,各物质的浓度都增大,故F正确,
故答案为:A、C、F;
(4)等体积混合后硫酸根为1.0×10
-3mol/L,根据溶度积可知,Ba
2+离子最小浓度为
mol/L=1.08×10
-7mol/L,故BaCl
2溶液的最小浓度为1.08×10
-7mol/L×2=2.16×10
-7mol/L,
故答案为:2.16×10
-7mol/L;
(5)SO
2的漂白原理是与有色物质化合生成无色不稳定的化合物,SO
2使酸性KMnO
4褪色,是SO
2表现还原性而不是漂白性;KMnO
4酸性条件下的还原产物为Mn
2+化合价降低5,SO
2被氧化成SO
42-化合价升高2,根据电子转移守恒,可得5x=2y,故x:y=5:2,
故答案为:5:2.
点评:本题比较综合,涉及混合物计算、化学平衡常数计算、化学平衡影响因素、溶度积计算、氧化还原反应计算等,是对学生综合能力的考查,(1)中注意利用极限法解答,难度中等.

 SO3(g)
SO3(g)

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案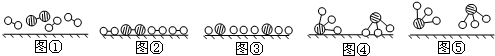
 、
、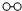 、
、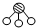 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程